Металлическая связь — химическая связь, обусловленная свободными электронами. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Зонная теория твёрдого тела — квантовомеханическая теория движения электронов в твёрдом теле. 9. Металлы вещества, обладающие в обычных условиях характерными, металлическими, свойствами-высокими электрической проводимостью и теплопроводностью. отрицательным температурным коэффициентом электрической проводимости, способностью хорошо отражать световые волны (блеск), пластичностью. К металлы относятся как собственно металлы (простые вещества), так и их сплавы, металлические соединения. В металлах существует металлическая связь, характеризующаяся тем, что кристаллическая решетка образована положительными ионами, тогда как валентные электроны делокализованы по всему пространству решетки. Классификация металлов Все металлы делятся на четыре группы: s -металлы (все s -элементы, кроме Н и Не), р-металлы (элементы грeggs IIIа, кроме В, а также Sn, Рb, Sb, Bi, Ро), d- M. и f -металлы.
10.Межмолекулярные взаимодействия, взаимодействия молекул между собой, не приводящее к разрыву или образованию новых химических связей. Межмолекулярные взаимодействия определяют отличие реальных газов от идеальных, существование жидкостей и молекулярных кристаллов. От межмолекулярных взаимодействий зависят многие структурные, спектральные, термодинамические, теплофизические и другие свойства веществ. Появление понятия межмолекулярные взаимодействия связано с именем Й. Д. Ван-дер-Ваальса, который для объяснения свойств реальных газов и жидкостей предложил в 1873 уравнение состояния, учитывающее межмолекулярные взаимодействия. Поэтому силы межмолекулярного взаимодействия часто называют ван-дер-ваальсовыми. Виды межмолекулярных взаимодействий. Основу межмолекулярных взаимодействий составляют кулоновские силы взаимодействия между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых свойствах вещества проявляется усредненное взаимодействие, которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физических характеристик (дипольного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры l самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы межмолекулярного взаимодействия можно достаточно обоснованно подразделить на три вида - электростатические, поляризационные (индукционные) и дисперсионные. Электростатические силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризационными силами, если молекулы анизотропны.Проявление сил отталкивания – малая сжимаемость жидкости.
Соотношение сил когезии и адгезии и сил теплового движения молекул определяет агрегатное состояние вещества.
Силы столкновения: проявляют себя на очень малых расстояниях и обычно убывают с увеличением расстояния. Их можно определить в качестве исходного коэффициента. 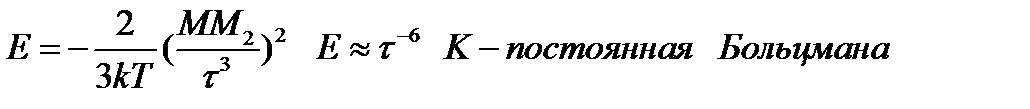
11) Строение реальных кристаллов. Дефекты кристаллов. Монокристаллы.
1. Молекулярные кристаллы:
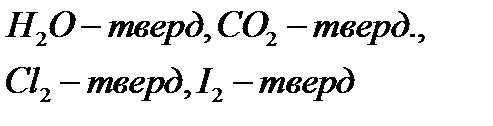
В молекулярных узлах решетки находится молекула. Между узлам такой решетки будет молекулярная связь (силы Вандервальса).
Силы Вандервальса:
Энергия: 0.4 - 4.2 кДж/моль так как эта энергия мала – кристаллы обладают:
-большой летучестью
-низкой температурой плавления.
-диэлектрики.
Плотность упаковки определяет хим. связи внутри молекулы. Для молекулярных кристаллов применимы все стеклометрические законы.
2. Атомные кристаллы с металлической связью (атомные металлические решетки) 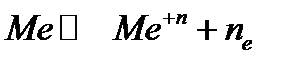 .
.
Металлы реализуют металлическую связь, в силу металлической связи кристаллы обладают:
- хорошей теплопроводностью
хорошие проводники
Атомные кристаллы с ковалентной связью: графит, алмаз, и тд.
В плоских решетках между узлами суммируется ковалентная связь:
-направленная
-насыщенная
За счет ковалентной связи кристаллы обладают:
невысокое координационное число
высокие температуры плавления
большая твердость
диэлектрики, полупроводники
электронная проводимость
энергия кристаллической решетки велика (она определяется прочностью ковалентной связи)
Ионные кристаллы:
NaCl, CsCl
В узлах – ионы, между которыми кулоновские взаимодействия.
Ионная связь: ненаправленная, ненасыщенная
Кристалл – как одна большая молекула.
За счет ионной связи кристаллы обладают:
малая твердость
диэлектрики, полупроводники
высокая температура плавления
Реальные кристаллы: дефект кристаллов – нарушение дальнего порядка кристаллической решетки.
Для реальных кристаллов всегда имеет место дефект.
Дефект кристаллической решетки появляется:
тепловое воздействие на кристалл
возможно внедрение в решетку примесей
механическое напряжение в кристалле
Дефекты:
точечные дефекты – это нарушение в 1-2 узла или междоузлие в расчете на 1 элементарную ячейку.
12) Растворимость. Способы выражения состава раствора.
Растворимость – это способность вещества растворяться в том или ином растворителе.
Мерой растворимости вещества при данных условиях является его содержание в насыщенном растворе, т.е. там, где установилось равновесие между раствором и веществом, которое осталось нерастворённым. Способы выражения состава раствора: Массовая доля растворенного вещества - это есть отношение массы растворенного вещества (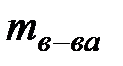 ) к массе раствора (
) к массе раствора (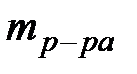 ).
). 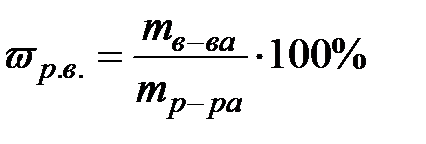 ,следует учесть, что
,следует учесть, что 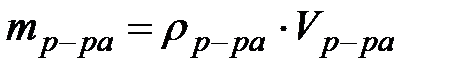 ,
, 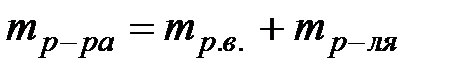 . Молярная концентрация растворенного вещества – это отношение количества моль растворенного вещества (n) к объему раствора (V) или число моль растворенного вещества в 1 литре раствора.
. Молярная концентрация растворенного вещества – это отношение количества моль растворенного вещества (n) к объему раствора (V) или число моль растворенного вещества в 1 литре раствора. 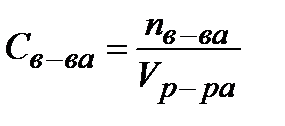 . Молярная концентрация эквивалента растворенного вещества – это есть отношение количества эквивалентов растворенного вещества (nэкв) к объему раствора (V).
. Молярная концентрация эквивалента растворенного вещества – это есть отношение количества эквивалентов растворенного вещества (nэкв) к объему раствора (V). 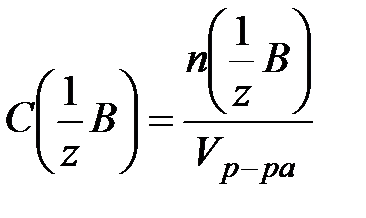 . Моляльная концентрация – это есть количество моль растворенного вещества (n) в 1 кг растворителя (или в 1000 г растворителя).
. Моляльная концентрация – это есть количество моль растворенного вещества (n) в 1 кг растворителя (или в 1000 г растворителя). 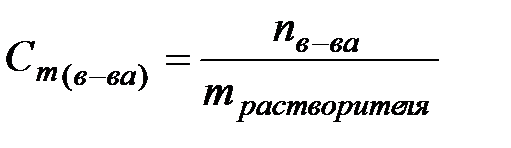 . Молярная доля растворенного вещества – это отношение количества моль растворенного вещества к сумме количеств (к сумме моль) всех веществ, составляющих раствор.
. Молярная доля растворенного вещества – это отношение количества моль растворенного вещества к сумме количеств (к сумме моль) всех веществ, составляющих раствор. 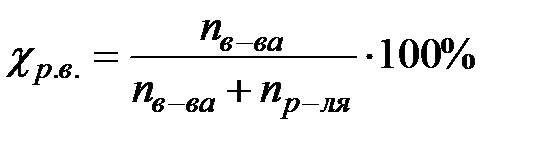
13) Общие свойства растворов не электролитов.
Растворы имеют ряд свойств, которые при данной температуре зависят только от числа частиц растворенного вещества. Эти свойства называют коллигативными: чем больше частиц в растворе, тем сильнее выражены коллигативные свойства.
К коллигативным свойствам относятся: 1 ) давление пара растворов: Над любой жидкостью устанавливается определённое давление пара, насыщающее пространство.Это давление характеризует состояние равновесия между жидкой фазой и находящимися над нею паром.Если в жидкость внесено практически нелетучее вещество, то число молекул растворителя, испаряющихся с поверхности жидкости, сокращается, что вызывает уменьшение давления пара над раствором, и равновесие устанавливается при более низком давлении, чем для чистого раствора.Согласно закону Рауля: Относительное понижение парциального давления насыщенного пара растворителя над разбавленным раствором неэлектролита равно мольной доле растворённого вещества: 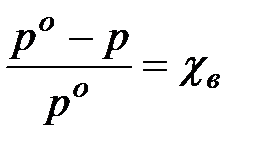
2) температура кипения и кристаллизации разбавленных растворов.
Фазовые превращения при образовании растворов могут быть описаны температурами кипения и кристаллизации, которые вследствие понижения давления пара над раствором, отличаются от соответствующих значений для чистых растворителей и зависят от концентрации растворённых веществ. Температура, при которой давление насыщенного пара жидкости равно нормальному давлению, называется нормальной температурой кипения. Для сильно разбавленных растворов в различных растворителях Раулем было установлено: понижение температуры кристаллизации или повышение температуры кипения разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации растворённого вещества: 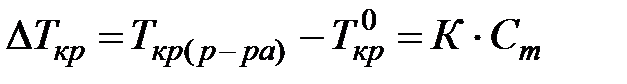 ,
, 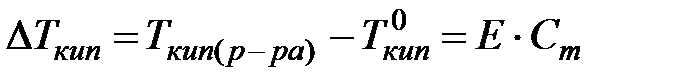
3) осмотическое давление. При соприкосновении раствора и чистого растворителя, которые разделены полупроницаемой (т.е. проницаемой только для молекул растворителя) мембраной, растворитель проникает в раствор, преодолевая избыточное давление до достижения его равновесного значения – осмотического давления. Осмотическое давление не зависит от природы растворителя и растворенного вещества. Осмотическое давление может быть определено по закону Вант-Гоффа: Осмотическое давление численно равно тому давлению, которое оказывало бы растворенное вещество, если бы оно при данной температуре находилось в состоянии идеального газа и занимало объём, равный объёму раствора: 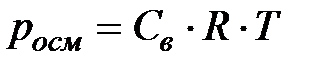
14) Общие свойства растворов электролитов. Сильные электролиты. Изотонический коэффициент.
Вещества, водные растворы или расплавы, которые проводят электрический ток, называются электролитами.
Распад электролитов на ионы под действием молекул растворителя называются электролитической диссоциацией.
Количественными характеристиками электролитической диссоциации являются:
1) степень электролитической диссоциации 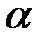 – это отношение числа молекул, распавшихся на ионы (
– это отношение числа молекул, распавшихся на ионы (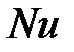 ), к общему числу молекул растворенного вещества в растворе (
), к общему числу молекул растворенного вещества в растворе (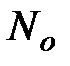 ):
): 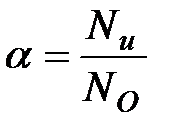
2) константа электролитической диссоциации 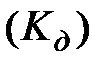 – это константа химического равновесия для процесса диссоциации электролита:
– это константа химического равновесия для процесса диссоциации электролита:  ;
; 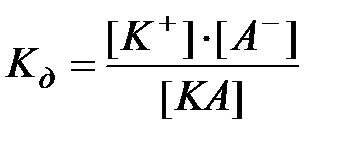
Изотонический коэффициент (i) – это отношение суммы числа ионов и непродиссоциированных молекул электролитов к начальному числу молекул.
Изотонический коэффициент показывает, во сколько раз в растворе электролита возрастает общее число частиц по сравнению с числом молекул, введенных в раствор.Изотонический коэффициент может быть выражен через степень электролитической диссоциации 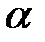 :
: 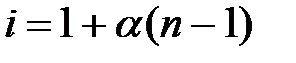
15) Дисперсные системы. Классификация дисперсных систем. Особые свойства дисперсных систем.
Коллоидным называется такое состояние вещества, при котором хотя бы один из геометрических параметров не превышает 10‑6 м.
Если из трех параметров только один менее 10‑6 м, то такие системы называют пленками. Если два параметра менее 10‑6 м, то такие системы называют волокнами или нитями. Если все три параметра менее 10‑6 м, то такие системы называют просто дисперсными или коллоидными.
Коллоидное состояние достаточно широко распространено в природе. Дым, туман, пленка масла на воде, молоко, чай – все это примеры существования коллоидных систем.
Рассмотрим классификации коллоидных систем:
1. В качестве меры измельчённости применяют такой параметр как дисперсность d, равный обратному радиусу 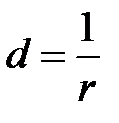 . По степени измельчённости выделяют следующие системы.
. По степени измельчённости выделяют следующие системы.
2. По агрегатному состоянию дисперсионной среды коллоидные системы классифицируют следующим образом.
деление куба на 1000 частей приводит к десятикратному увеличению общей площади поверхности. При делении каждой из граней исходного куба в 10000 раз (L = 1 мкм) общая площадь поверхности увеличится в 10000 раз. Общую энергию тела можно выразить через суммарную энергию внутренних частиц и суммарную энергию поверхностных частиц
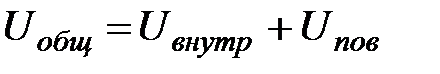
Для крупных частиц Uвнутр >> Uпов. При измельчении увеличивается общее число поверхностных частиц. Uвнутр почти не изменяется, а Uпов значительно возрастает. При определенной степени измельчения Uпов начинает вносить основной вклад в Uобщ. Размер частиц, с которых начинается резкое увеличение Uобщ и служит верхней границей существования коллоидных систем. Поскольку особые свойства коллоидных систем обусловлены высокой удельной площадью поверхности, то часто можно встретить термин «поверхностные явления» применительно к особым свойствам коллоидных систем.
16) Устойчивость дисперсных систем. Факторы, влияющие на различные типы устойчивости.
Понятие «дисперсные системы» объединяет широчайший класс объектов окружающего нас
мира, содержащих частицы размером от нескольких нанометров до сотен микрон. Это системы,
состоящие из двух и более фаз: твердой, жидкой и газовой. Фаза, являющаяся непрерывной
(сплошной), называется дисперсионной средой; другая фаза, раздробленная и распределенная в
этой среде, — дисперсной фазой. Дисперсных фаз в системе может быть несколько. (Например, в
воздушной дисперсионной среде могут присутствовать частицы пыли разного химического со-
става и строения, капельки воды)
Каждая из этих фаз характеризуется равновесным состоянием вещества с определенной со-
вокупностью физических и химических свойств. Переход от одной фазы к другой связан со скач-
кообразным, качественным изменением свойств вещества, что и определяет главную особенность
дисперсных систем — их гетерогенность (в отличие от гомогенности образующих ее фаз). Физи-
ческие и физико-химические процессы вблизи поверхности раздела между фазами (межфазной
границы) составляют группу «поверхностных явлений». Они возникают как результат различия в
составе и строении соприкасающихся фаз и соответственно различия в энергии связи атомов и
молекул, находящихся у поверхности раздела фаз и в их объеме. Из-за этого вблизи межфазной
границы существует ненасыщенное (некомпенсированное) поле межатомных, молекулярных сил,
называемых поверхностными силами
17) Адгезия, когезия. Механизм возникновение. Работа адгезии и когезии.
Адгезия (от лат. adhaesio — прилипание), слипание поверхностей двух разнородных твёрдых или жидких тел.
Когезия (от лат. cohaesus — связанный, сцепленный), сцепление молекул (атомов, ионов) физического тела под действием сил притяжения. Это силы межмолекулярного взаимодействия, водородной связи и (или) химической связи. Они определяют совокупность физических и физико-химических свойств вещества: агрегатное состояние, летучесть, растворимость, механические свойства и т.д. Процесс образования адгезионной связи обычно делят на две стадии. На первой, так называемой транспортной стадии, происходит перемещение молекул адгезива (клеющего вещества, связующего) к поверхности субстрата (тело, на которое наносится адгезив) и их определенное ориентирование в межфазном слое, в результате чего обеспечивается тесный контакт между молекулами и функциональными группами молекул адгезива и субстрата. Вторая стадия адгезии состоит в непосредственном взаимодействии адгезива и субстрата, которое может быть обусловлено различными силами — от ван-дер-ваальсовых до химических. Силы ковалентных связей начинают действоватьна расстояниях между атомами и молекулами, не превышающих 0,5 нм.
18. Поверхностно-активные вещества (ПАВ), вещества, адсорбция которых из жидкости на поверхности раздела с другой фазой (жидкой, твердой или газообразной) приводит к значит. понижению поверхностного натяжения (см. Поверхностная активность). В наиболее общем и важном с практической точки зрения случае адсорбирующиеся молекулы (ионы) ПАВ имеют дифильное строение, т. е. состоят из полярной группы и неполярного углеводородного радикала (дифильные молекулы). Поверхностной активностью в отношении неполярной фазы (газ, углеводородная жидкость, неполярная поверхность твердого тела) обладает углеводородный радикал, который выталкивается из полярной среды. В водном растворе ПАВ на границе с воздухом образуется адсорбционный мономолекулярный слой с углеводородными радикалами, ориентированными в сторону воздуха. По мере его насыщения молекулы (ионы) ПАВ, уплотняясь в поверхностном слое, располагаются перпендикулярно поверхности (нормальная ориентация). Смачивание, поверхностное явление, наблюдаемое при контакте жидкости с твердым телом в присутствии третьей фазы-газа (пара) или другой жидкости, которая не смешивается с первой (так называемое избирательное смачивание). Характерная особенность смачивание-наличие линий контакта трех фаз (линии смачивание). Основные термодинамические характеристики смачивания - равновесный краевой угол смачивания q0, работа адгезии Wa, теплота смачивания qW. Равновесный краевой угол смачивание определяется наклоном поверхности жидкости (например, капли) к смоченной ею поверхности твердого тела; вершина угла находится на линии смачивание Равновесный краевой угол определяется уравнением Юнга
19) Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье. Все химические реакции по направленности делят на:
1. необратимые – протекают до полного израсходования одного из веществ, и не способны менять свое направление при изменении температуры и давления.
2. обратимые – протекают одновременно при данных условиях, как в прямом, так и в обратном направлении.
Смещение химического равновесия. Принцип Ле-Шателье
Изменение условий, при которых система находится в состоянии химического равновесия, вызывает нарушение равновесия в результате неодинакового изменения скоростей прямой и обратной реакции. С течением времени в системе устанавливается новое химическое равновесие, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом или смещением положения равновесия.Направление смещения положения химического равновесия в результате изменения внешних условиях определяется принципом Ле Шателье:если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то равновесие смещается в сторону того процесса, который уменьшает это воздействие.
1. влияние температуры на состояние равновесия определяется знаком теплового эффекта:при повышении температуры равновесие обратимой реакции смещается в сторону эндотермической реакции; при понижении температуры (охлаждении) равновесие обратимой реакции смещается в сторону экзотермической реакции.
2. влияние давления на состояние равновесия определяется изменением объема или количества моль газообразных веществ в ходе реакции:
3. влияние концентрации реагирующих веществ на состояние равновесия:
при увеличении концентрации какого-либо вещества (путем его добавления) равновесие обратимой реакции смещается в сторону реакции, по которой это вещество реагирует, то есть расходуется. При уменьшении концентрации какого-либо вещества равновесие обратимой реакции смещается в сторону реакции, по которой это вещество образуется.
20) Закон Гесса и следствия из него Термохимические расчёты.
Раздел химии, изучающий тепловые эффекты реакций, называется термохимией.
Термохимические уравнения - химические уравнения, записанные с указанием теплового эффекта реакции и агрегатного состояния веществ.
В общем случае, в изолированном процессе, теплоту Q, выделяемую или поглощаемую в ходе реакции, называют тепловым эффектом реакции.
Тепловой эффект обычно приводится для 1 моль вещества и измеряется в джоулях или килоджоулях.
Реакции, протекающие с выделением теплоты, называются экзотермическими 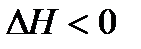 .
.
Реакции, протекающие с поглощением теплоты, называют эндотермическими  Н> 0.
Н> 0.
Следует отметить, что коэффициенты термохимических уравнений могут иметь и дробные величины.
Закон Гесса: Для расчетов тепловых эффектов различных процессов используется закон.
Тепловой эффект реакции не зависит от пути протекания процесса, а определяется лишь начальным и конечным состоянием веществ, участвующих в реакции. Закон Гесса справедлив для любых процессов, происходящих с изменением энергии. При расчетах тепловых эффектов химических реакций на основе закона Гесса используются стандартные теплоты образования и сгорания веществ:
1. Тепловой эффект химической реакции равен разности сумм стандартных теплот образования продуктов реакции и исходных веществ 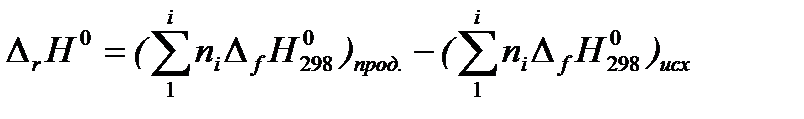
21) Энтропия. Изменение энергии в различных процессах. Энергия Гиббса.
Энтропия (от греч. entropía — поворот, превращение), понятие, впервые введенное в термодинамике для определения меры необратимого рассеяния энергии.
 2018-01-21
2018-01-21 1095
1095