Химическая кинетика - раздел химии, который изучает скорость химических реакций и факторы, от которых скорость зависит.
Концентрация выполняет роль скорости.
aA + bB = eE + fF (8-1)
vср = 
vср = 
V =  ; V =
; V = 
Скорость реакции зависит от температуры, концентрации реагентов, природы реакции и ряда других факторов.
Надо так же иметь ввиду систему, в которой проходит реакция (прим. гомогенная).
Зависимость скорости гомогенной реакции от концентрации выражается законом действия масс (Гульдберг и Вааге).
При постоянной температуре скорость гомогенной хим. реакции прямо пропорциональна произведению концентраций реагирующих вещ-в.
V = k*CaA*CbB (или записываем по-другому) V = k*[A]*[B] (8-2)
CaA и CbB - концентрации А и В (то же и [A], [B])
k - константа скорости реакции (при данной t), отражает природу хим. реации
a+b ≤ 3 (8-3)
Подавляющее большинство реакций протекают в несколько стадий. Выражение (8-2) справедливо для каждой стадии.
N2 + 3H2 ↔ 2NH3 (*)
Для * уравнение 8-2 можно применить лишь тогда, когда реакция состоит из 1 стадии (элементарная реакция)
N2 + O2 ↔ 2NO,ΔH>0 (тепло поглощается, эндотермическая)
Зависимость скорости реакции от температуры выражается приближенным правилом Вант-Гоффа:
при увеличении температуры на каждые 10°С скорость хим. реакции возрастает в 2...4 раза.
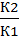 = γn
= γn
K1 и К2 - константы скорости при t2 и t1
γ - температурный коэф. скорости реакции
n = 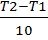
Применительно к гетерогенным реакциям в уравнении (8-2) не указывают более конденсированные реагенты.
А(г) + В(т) = E
v(вектор) = k * CA(г)
Электрохимия
 2018-01-21
2018-01-21 290
290








