вода - очень слабый электролит H2O ↔ H+ + OH-
α=1.9 * 10-9
t = 22°C
При t↑, α↑, но все равно остается малой величиной
Для чистой воды:
Сн+ = Сон- = αСН2О
СН2О = 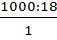
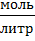 = 55.5
= 55.5 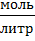 (концентрация воды в воде)
(концентрация воды в воде)
СН+ = СОН- = 1.9 *10-9 * 55.5 = 1 * 10-7 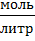
pH - водородный показатель
pH = -lgCH+= 7; pOH = -lgCOH- = 7 (7-5)
В нейтральной среде (чистая вода) pH = -lg10-7=7
Точно так же и pOH = 7.
Применительно к (7-4):
Кд= 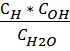
Отсюда: Кд * Сн2о = СН * СОН = const - ионное произведение воды(ИПВ)
Значение этой величины можно вычислить, т.к. известны концентрации в нейтральной среде.
ИПВ= СН * СОН = 10-7 * 10-7 = 10-14 (7-6)
Уравнение (7-6) можно записать в другом виде
pH + pOH = 14 (7-7)
Для получения 7-7, обе части 7-6 логарифмуют и умножают на -1:
(lg10-7 + lg10-7)*(-1) = 14
Как видно из 7-6 и 7-7 pH и pOH связаны, поэтому водные среды характеризуют обычно с помощью pH, независимо от того, какая среда: кислая, нейтральная или щелочная. Более кислые среды характеризуются меньшим значением pH = 10-5 и 10-3; pH = 5 и pH = 3. В кислых средах pH < 7, а в щелочных pH>7.
Произведение растворимости малорастворимого вещ-ва
Над осадком малорастворимого вещ-ва образуется раствор этого вещ-ва, но с малой концентрацией.
Ca3(PO4)2 ↔ 3Ca22+ + 2PO43-
ПР = 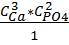
ПР - произведение растворимости (в справочнике)
 2018-01-21
2018-01-21 386
386








