АГРЕГАТИВНАЯ УСТОЙЧИВОСТЬ- сохранение межфазовой поверхности и поверхностной энергии.
Устойчивость определяется способностью дисперсных систем противодействовать слипанию частиц. Взаимодействие и слипание твердых частиц приводит к образованию агрегатов. В результате происходит укрупнение частиц, структура дисперсной фазы изменяется, а агрегаты приобретают способность оседать или всплывать. Агрегация и укрупнение частиц называется коагуляцией.
Все дисперсные системы по механизму образования классифицируются:
1. Лиофильные - получаются при самопроизвольном диспергировании одной из фаз.
2. Лиофобные - получаются в результате диспергировании с конденсацией с пересыщением (не самопроизвольно)
В лиофобных системах, если они не закреплены стабилизатором, идут самопроизвольные процессы укрупнения частиц. Такие системы называют агрегативно-неустойчивыми.
Укрупнение может идти двумя путями:
1. изотермическая перегонка - перенос вещества от мелких частиц к крупным,
2. коагуляция - слипание частиц.
Агрегативная устойчивость нестабилизированных систем носит кинетический характер и судить о ней можно по скорости процессов, вызываемых избытком поверхностной энергии. Агрегативная устойчивость может носить и термодинамический характер, если дисперсная система не обладает избытком поверхностной энергии.
ТЕРМОДИНАМИЧЕСКИЕ И КИНЕТИЧЕСКИЕ ФАКТОРЫ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
1. Электростатический - уменьшение межфазного натяжения из-за возникновения ДЭС на поверхности частиц.
2 .Адсорбционно-сольватный - уменьшение межфазного натяжения при взаимодействии частиц дисперсной фазы со средой.
3. Энтропийный - действует в системах, где частицы участвуют в тепловом движении.
4. Структурно-механический - на поверхности частиц имеются пленки, обладающие упругостью и механической прочностью, разрушение их требует затраты энергии.
5. Гидродинамический - уменьшение скорости коагуляции, благодаря изменению вязкости среды.
6.Смешанные факторы.
Изотермическая перегонка может происходить практически во всех системах. Частицы разных размеров обладают неодинаковыми химическими потенциалами, что создает движущую силу переноса вещества от мелких частиц к крупным. Этот процесс ведет к исчезновению мелких частиц, уменьшению средней дисперсности, уменьшению свободной энергии поверхности.
3 стадии:
1.растворение и испарение мелких частиц,
2.перенос вещества к крупным частицам,
3.рост крупных частиц.
(1) и (3) стадии - химические процессы, (2) стадия диффузионная.
Скорость изотермической перегонки часто лимитируется (2) стадией, которая подчиняется закону Фика и зависит от градиента концентраций или давлений, которые, в свою очередь, определяются размером частиц
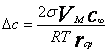
где Dс - скорость диффузионного массопереноса (разность концентраций у поверхности малой и большой частиц, VМ - мольный объем, rср - средний радиус частиц, s - поверхностное натяжение.
То есть перенос вещества зависит от:
1.коэффициента диффузии,
2.размеров частиц,
3.растворимости дисперсной фазы,
4.поверхностного натяжения,
5.температуры.
Если дисперсная фаза хорошо растворима в дисперсионной среде, то система обладает малой устойчивостью по отношению к изотермической перегонке. Этим объясняется невозможность получения высокодисперсных систем при хорошей растворимости дисперсной фазы. Межфазное натяжение способствует переносу вещества.
КИНЕТИКА КОАГУЛЯЦИИ
Коагуляция протекает в термодинамически неустойчивых дисперсных системах. Смолуховским была рассмотрена коагуляция монодисперсных золей со сферическими частицами, которые сталкиваются между собой в результате броуновского движения.
Чтобы определить число столкновений, рассматривают диффузный поток частиц через сферу, окружающую одну частицу, фиксированную в начале координат. Коэффициент диффузии движущейся частицы равен сумме коэффициентов диффузии сталкивающихся n- и m-мерных частиц.
Dnm = Dn + Dm (9.2)
Поток через сферическую частицу по закону Фика:
Inm = 4pR nmD nmn nm (9.3)
концентрация частиц: n nm = k nmn mn n (9.4),
Умножим (9.2) на (9.3), получим:
k nm = 4pR nmD nm (9.5)


При каждом столкновении два агрегата дают один.
dn/dt = knt2, решение этого выражения дает уравнение Смолуховского:

t к - время коагуляции, n0 - исходная концентрация системы.
Различают кинетику медленной и быстрой коагуляции.
Быстрая коагуляция.
При быстрой коагуляции все столкновения частиц эффективны, то есть приводят к слипанию частиц. Быстрой коагуляции отвечает условие равенства нулю потенциального барьера DЕ = 0 и равенство единице стерического множителя Р = 1.(Р учитывает благоприятные пространственные расположения частиц при столкновении).
Константа скорости быстрой коагуляции равна:
Кб=8pDR (9.8)
Если учесть, что R = 2r, D = k БТ/(6phr),то
Кб=8kБТ/3h (9.9)
Из соотношения (9.9) следует, что константа скорости быстрой коагуляции зависит только от температуры и вязкости среды. Вязкость жидкостей, как правило, уменьшается с повышением температуры, что обуславливает резкую зависимость константы скорости коагуляции от температуры.
Медленная коагуляция.
DЕ не равна нулю.
Км=КбРехр(DЕ/(кБТ)) (9.10)
Связь эффективности соударений с потенциальным барьером была показана Фуксом. Он ввел понятие коэффициента замедления W, который показывает, во сколько раз Км меньше Кб.
W=Кб/Км=1/Рехр(DЕ/(кБТ) (9.11)
ТЕРМОДИНАМИЧЕСКАЯ ТЕОРИЯ АГРЕГАТИВНОЙ УСТОЙЧИВОСТИ ДИСПЕРСНЫХ СИСТЕМ
Лиофильные (термодинамически агрегативно устойчивые) дисперсные системы могут образовываться самопроизвольно. То есть из любого агрегатного состояния система переходит в данное состояние с уменьшением DG, то есть лиофильные системы - равновесные и обратимые.
DG = DН - ТDS < 0
DН < ТDS
DН характеризует межфазное натяжение, DН не может уменьшаться до 0, так как система должна оставаться гетерогенной.
Наличие DS возможно у дисперсных систем, частицы которых способны к броуновскому движению. То есть из свободнодисперсных систем термодинамически устойчивыми могут быть только ультрамикрогетерогенные - золи.
Условие термодинамической агрегативной устойчивости.
(¶DG/dS)s<0 и (¶DG/dr)s<0 (9.12)
Это означает, что DG не должно увеличиваться с ростом межфазной поверхности или с уменьшением размера частиц.
Наиболее типичные представители лиофильных коллоидных систем - растворы коллоидных поверхностно активных веществ (ПАВ) и высокомолекулярных соединений (ВМС).
Термодинамически устойчивые к коагуляции лиофобные системы могут быть рассмотрены аналогично лиофильным, если представить уже раздробленную и стабилизированную фазу.
Стабилизаторы увеличивают энтропийную составляющую. Такие системы не могут образовываться самопроизвольно, но могут самопроизвольно пептизировать после коагуляции.
Энергия Гиббса смешения DG N - мера термодинамической агрегативной устойчивости дисперсных систем.


n = n + + n- - стехиометрический коэффициент диссоциирующей частицы.
Условие т/д агрегативной устойчивости: DG N < 0,
Критическое значение межфазного натяжения, выше которого система теряет агрегативную устойчивость (DG N = 0).

При отсутствии ДЭС (n = 1)
 (9.15)
(9.15)
d - средний размер частиц, n - безразмерный множитель, учитывающий влияние концентрации частиц.
Чтобы использовать это уравнение для более конкретного рассмотрения влияния различных факторов на агрегативную устойчивость ионно-стабилизированных систем, оно было преобразовано: Стехиометрический коэффициент можно представить с помощью числа способных к диссоциации поверхностных функциональных групп А0 на единице поверхности, степени их диссоциации a и заряда противоионов z:
 (9.16)
(9.16)
Подставим в это выражение (9.14), получим:
 (9.17)
(9.17)
Из общих критериальных соображений следует, что критическое межфазное натяжение тем выше, чем больше стехиометрический коэффициент диссоциирующей частицы и меньше размер частиц и их концентрация. Диссоциация частиц лиофильных систем облегчает образование системы. Для стабилизации лиофобных систем необходимо обеспечить достаточную плотность способных к диссоциации групп на поверхности частиц, их диссоциацию, а также образование ДЭС.
Таким образом, т/д устойчивость к коагуляции лиофобных систем может быть обеспечена путем формирования поверхностных слоев, способных уменьшить межфазное натяжение и увеличить энтропию до требуемых значений.
42. Суспензии. Эмульсии. Пены. Аэрозоли.
Гетерогенные системы, состоящие из двух или более фаз, одна из которых равномерно раздроблена в другой, называются дисперсными.
Фаза, которая раздроблена, называется дисперсной фазой («д.ф.»).
Фаза, в которой раздроблена дисперсная фаза, носит название дисперсионной среды («д.с.»).
Классифицируют дисперсные системы по следующим признакам:
по степени раздробленности дисперсной фазы различают высокодисперсные и грубодисперсные системы. Мерой раздробленности вещества является дисперсность, обозначаемая буквой «D». Она обратно пропорциональна среднему линейному размеру его частиц и измеряется в обратных метрах:
D = 1/d (м -1)
Если частица имеет сферическую форму, то d – длина ее диаметра, если – кубическую, то размер ребра куба.
Чем больше дисперсность, тем выше удельная поверхность измельченного вещества. С ув площади поверхности ув поверхностная энергия частиц, находящихся на границе раздела фаз гетерогенной системы. Это приводит к повышению реакционной способности вещества и делает возможным самопроизвольное протекание различных поверхностных явлений (адсорбции, смачивания).
Средний размер частиц дисперсной фазы высокодисперсных систем лежит в интервале 10 −9 – 10 -7 м. Такие системы называют коллоидными. Природные коллоидные системы – это космическая пыль, сок растений. В технике используют высокодисперсные краски, аэрозоли.
Грубодисперсные системы состоят из частиц размером от 10 -7 до 10 - 4 м. Такие системы называют микрогетерогенными, так как их частицы можно увидеть в обычный микроскоп. К ним относятся биологические жидкости (кровь), продукты питания (молоко, хлеб), природные системы (туман, облака), технические материалы (краски, эмульсии, пены);
Примеры указанных систем представлены в таблице 1.
| Дисперсионная среда | Дисперсная фаза | ||
| Газообразная | жидкая | твердая | |
| Газообразная | ─ | аэрозоли, ж / г туман, облака, духи, лекарства | аэрозоли, т / г пыль, дым, песчаные бури |
| Жидкая | жидкие пены, г / ж мыльная пена, пена огнетушителя | эмульсии, ж / ж молоко, сливочное масло, мазь, крем, СОЖ, нефть | коллоидные растворы, суспензии, т / ж соусы,кисели, клеи,краски |
| Твердая | твердые пены, г / т хлеб, шоколад, почва, пенопласт | гели, ж / т жемчуг | т / т сплавы металлов, драгоценные камни, цветные стекла |
По определению условием образования дисперсных систем является ограниченная растворимость или взаимная нерастворимость частиц дисперсной фазы и дисперсионной среды. По этой причине системы термодинамически неустойчивы и со временем должны расслаиваться на две отдельные фазы. Для обеспечения агрегативной устойчивости (способности частиц дисперсной фазы не слипаться) и кинетической устойчивости (способности не оседать) дисперсных систем в них вводят третий компонент – стабилизатор.
Дисперсные системы занимают промежуточное положение между растворами и гетерогенными системами, поэтому для их получения используются два способа – диспергирование (раздробление уже имеющейся фазы, нерастворимой в дисперсионной среде) или конденсацию (создание новой фазы из гомогенной системы и получение таким образом двухфазной системы).
Методы диспергирования делятся на физические и химические. Физическое может осуществляться механическим методом (взбалтыванием), ультразвуковым, электрическим (испарение металла электрода при образовании вольтовой дуги). Химическое, или пептизация, основано на обработке свежевыпавшего рыхлого осадка р-ром электролита или растворителя, приводящей к дезагрегированию частиц и распределению их по объему дисперсионной среды.
Конденсационные методы могут быть физическими или химическими. При химическом методе новая фаза образуется за счет химической реакции. Это может быть окислительно – восстановленная реакция для получения коллоидных растворов металлов (серебра) или неметаллов (серы):
AgNO3 + K2CO3 = Ag2O + 2KNO3 + CO2
Ag2O + C76H52O46 = 6Ag + C76H52O49,
2H2S + O2 = S + H2O.
С помощью реакции гидролиза получают коллоидный раствор гидроксида железа (III):
FeCl3 + 3H2O = Fe (OH)3 + 3HCl.
К наиболее распространенным дисперсным системам относятся эмульсии, суспензии, пены и аэрозоли.
Эмульсии – микрогетерогенные системы, по агрегатному состоянию фаз обозначаемые как «ж/ ж». Они образованы двумя взаимно несмешивающимися жидкостями, одна из которых в виде капель раздроблена в другой. В зависимости от полярности фаз существует два типа эмульсий: прямая эмульсия, обозначаемая как «м/в» и обратная эмульсия, которую записывают как «в/м». Полярную фазу называют «водой» («в»), а неполярную - «маслом» «м»). Примером природной эмульсии первого типа, т. е. типа «вода в масле» является молоко, состоящее из капелек жира, распределенных в воде, а второго типа, т.е. «вода в масле», - сливочное масло, нефть. Специфическим св-вом эмульсий является обращение их фаз, означающее обратимый переход из одного типа в другой. Это явление может быть вызвано механическим воздействием (встряхиванием) или заменой стабилизатора эмульсии, называемого «эмульгатором». Стабилизируют эмульсии обычно поверхностно- активные вещества (ПАВ).
Эмульсии применяют в технике в качестве смазочноохлаждающих жидкостей (СОЖ).
Суспензии – микрогетерогенные системы, соответствующие типу «т/ж». Разбавленные суспензии называют взвесями, к ним относится кровь, применяемые в технике строительные растворы и краски. Взвеси устойчивы только со стабилизаторами, роль которых могут выполнять порошки или ПАВ. Концентрированные суспензии называют пастами. В технике применяют абразивные пасты, в строительстве используют грунтовки, щпатлевки, мастики, краски. Концентрированные суспензии являются устойчивыми.
Пены – микрогетерогенные системы, представляющие собой дисперсию газов в жидкой (жидкие пены) или в твердой (твердые пены) дисперсионной среде. Примером природной твердой пены является пемза – продукт вулканической деятельности, искусственными твердыми пенами - хлеб, пенопласт, поролон. Стабилизатор жидкой пены называется пенообразователем. Хорошими пенообразователями являются мыла – соли высших органических кислот. Устойчивость пены определяется временем, за которое ее объем уменьшается вдвое. Она зависит от природы пенообразователя, температуры и вязкости дисперсионной среды. К свойствам пены относится кратность, т.е. отношение объема полученной пены к объему жидкости, из которой она образована. Кратность хорошей пены может достигать 1000 единиц. Концентрированные пены состоят из пузырьков газа или воздуха, окруженных тонкими структурированными жидкими пленками дисперсионной среды Пены используются для обогащения руд металлов методом флотации, при пожаротушении и т. д. Иногда явление пенообразования является нежелательным. Оно может также препятствовать перемешиванию при очистке сточных вод или в каких – либо технологических процессах. В этих случаях пены «гасят», добавляя специальные вещества – пеногасители, вытесняющие пенообразователь. Хорошими пеногасителями являются органические спирты.
Аэрозоли – это высокодисперсные или грубодисперсные системы с газообразной дисперсионной средой, обозначаемые как ж/г или т/г. Название аэрозолей зависит от способа получения. Полученные методом диспергирования капелек жидкости в газообразной среде аэрозоли называются «спреями», к ним относятся косметические средства (духи, дезодоранты), лекарства. При диспергировании твердых частиц горных пород в воздухе образуется пыль, разносимая ветром на огромные расстояния. Аэрозоли, таким образом, играют важную роль в круговороте химических элементов в природе. Методом конденсации капелек влаги в воздухе получаются облака и туманы, а при конденсации твердых частичек углерода – дымы. Аэрозоли устойчивы без стабилизатора по причине изоляционных свойств газообразной среды, не дающей слипаться рассеянным частицам, даже в том случае, если они заряжены. С коллоидными системами аэрозоли объединяет проявление светорассеивания (опалесценции). Специфическое свойство аэрозолей – явление термофореза (перемещение частиц аэрозоля от горячего к более холодному участку), вызванное большей интенсивностью ударов со стороны молекул газообразной среды на участках с повышенной температурой. Образующийся в атмосфере крупных промышленных городов, смог представляет собой аэрозоль сложного состава, состоящий из частиц твердой, жидкой и газообразной фаз, рассеянных в воздухе и обозначаемый как
т, ж, г/ г.
 2018-01-21
2018-01-21 8245
8245