
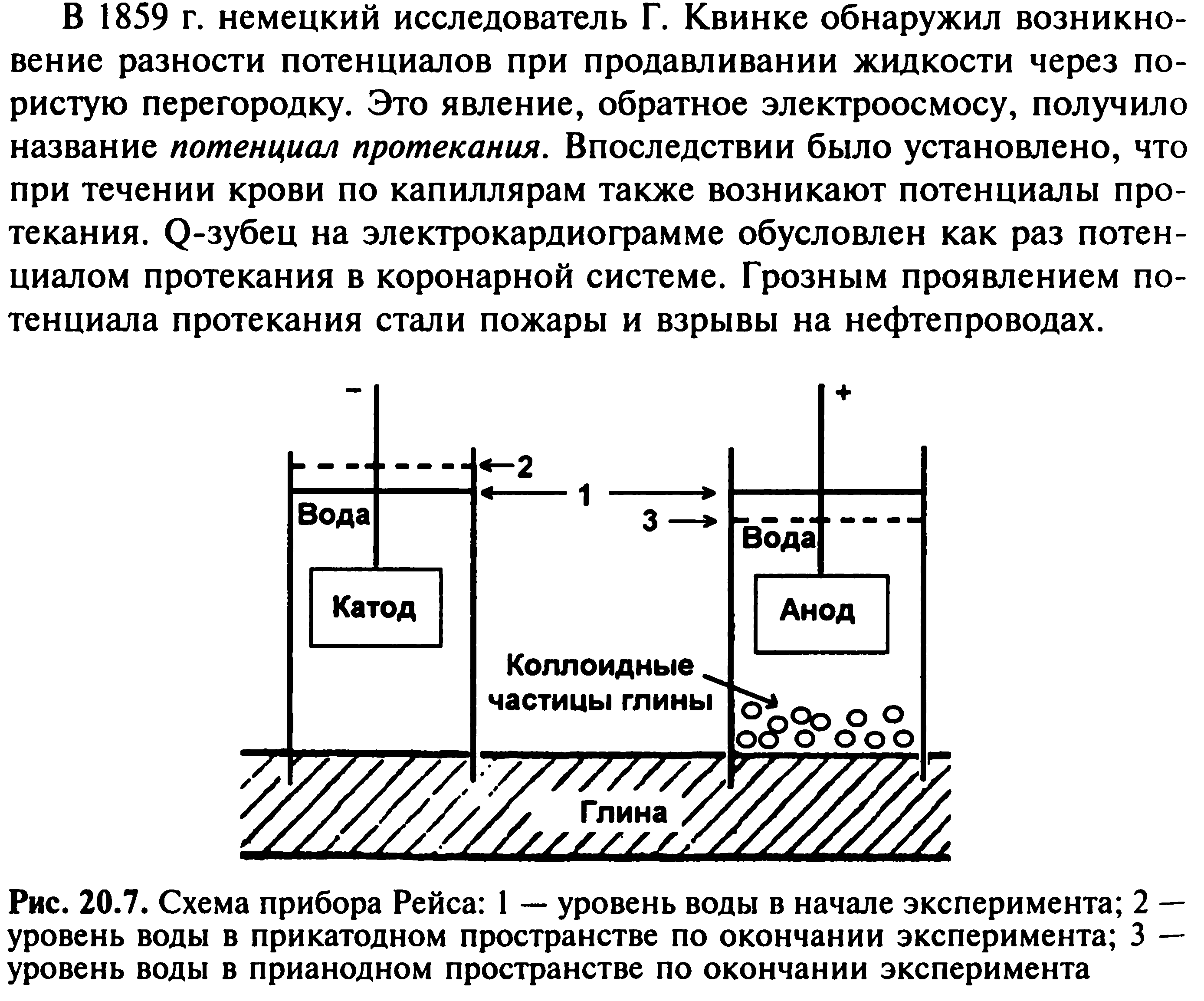





60. Мицеллы — частицы в коллоидных системах, состоят из нерастворимого в данной среде ядра очень малого размера, окруженного стабилизирующей оболочкой адсорбированных ионов и молекул растворителя. Средний размер мицелл от 10−5 до 10−7см. Нерастворимых веществ нет. Даже твёрдые вещества, которые, вроде бы, являются нерастворимыми, - тоже частично растворяются, при этом образуя мельчайшие частицы в растворителе мицеллы.Эти частицы проходят через фильтр. Они настолько мелкие и лёгкие, что не выпадают в осадок. Такие частицы (мицеллы) называют коллоидными. А растворы - коллоидные растворы. Строение мицеллы Коллоидная частица, называемая мицеллой, состоит из трех основных частей: ядра, адсорбционного и диффузионного слоев. На поверхности ядра мицеллы адсорбируются из раствора преимущественно те ионы, которые входят в кристаллическую решетку вещества, образующего ядро, и в растворе содержатся в избытке. Эти ионы сообщают поверхности ядра определенный заряд и являются потенциал образующими. Наряду с потенциал образующими ионами в адсорбционный слой мицеллы попадают молекулы растворителя или других веществ, присутствующих в растворе, и некоторое количество соответствующих противо-ионов. Остальная часть противоионов располагается в диффузионном слое.
Коагуляция лиофобных коллоидов. Как было показано выше, лиофобные коллоиды являются термодинамически неустойчивыми системами, существующими благодаря стабилизации за счет возникновения двойного электрического слоя. Изменение состояния ДЭС может, следовательно, привести к потере агрегативной устойчивости – слипанию частиц в более крупные агрегаты, т.е. коагуляции золя. Коагуляция золей может быть вызвана различными факторами: прибавлением электролитов, нагреванием или замораживанием, механическим воздействием и т.д. Наиболее важным и изученным фактором коагуляции гидрофобных коллоидов является воздействие на них растворов электПроблема устойчивости дисперсных систем является одной из важнейших в коллоидной химии. Обеспечение устойчивости таких коллоидных систем, как краски, клеи, лаки и т.д. имеет большое значение для полиграфической технологии и других отраслей промышленности.
По предложению Пескова Н. П. устойчивость дисперсных систем подразделяют на два вида: устойчивость к осаждению дисперсной фазы - седиментационная устойчивость и устойчивость к агрегации её частиц - агрегативная устойчивость. Седиментационная устойчивость характеризует способность дисперсной системы сохранять равномерное распределение частиц дисперсной фазы по объему дисперсионной среды. Седи-ментационной устойчивостью обладают ультрамикрогетерогенные системы, способные участвовать в броуновском движении, в результате которого частицы дисперсной фазы с размерами < 1 мкм практически равномерно распределяются по объёму дисперсионной среды.По отношению к агрегации дисперсные системы могут быть устойчивы термодинамически и кинетически. Термодинамически устойчивые дисперсные системы образуются в результате самопроизвольного диспергирования одной из фаз. Примерами таких систем могут служить растворы высокомолекулярных соединений (ВМС), мицеллярные растворы коллоидных ПАВ и другие. По классификации Ребиндера П. А. их называют лиофильными.ролитов.
61Согласно теории коагуляции, развитой Б. В. Дерягиным, коагуляция происходит при сближении коллоидных частиц на расстоянии, при котором энергия их взаимного притяжения становится больше энергии броуновского движения, отдаляющего частицы друг от друга. Этому сближению препятствуют диффузные слои, но так как в присутствии электролитов они сжимаются, то появляется возможность сближения частиц до необходимого расстояния, при котором наступает коагуляция. Все теории коагуляции в основном можно подразделить на адсорбционные и электростатические
Пептизация — расщепление агрегатов, возникших при коагуляции дисперсных систем, на первичные частицы под действием жидкой среды (например, воды) или специальных веществ — пептизаторов. Пептизация — один из способов получения коллоидных растворов, применяется в технике при получении высокодисперсных суспензий глин и других веществ.
Коллоидная защита — предохранение коллоидных растворов от коагуляции и, следовательно, повышение их устойчивости добавлением небольших количеств высокомолекулярных веществ (белков, крахмала, агар-агара и др.), так называемых защитных веществ. Коллоидная защиту используют при изготовлении устойчивых коллоидных препаратов серебра (колларгол), ртути, серы и других, применяемых в медицине.
62. Грубодисперсные системы, размер частиц в которых более 10-5 см называются грубодисперсными. К ним относят эмульсии, суспензии, порошки, пены. В таких системах коллоидные частицы можно увидеть невооруженным глазом и их растворы, как правило, не прозрачные. В грубодисперсных системах практически отсутствует броуновское движение, поэтому они кинетически неустойчивы. Частицы дисперсной фазы в них сравнительно быстро оседают или всплывают.Многие пищевые продукты относят к этой группе дисперсных систем – молоко, майонез, сливочное масло (эмульсии); суфле, муссы, пастила, зефир, хлеб (пены); мука, крахмал, какао (порошки); суспензия крахмала в воде, протертые супы, шоколад (суспензии); дым, мучная и сахарная пыль (аэрозоли).
Суспензиями называют системы, в которых твёрдое вещество находится в жидкой дисперсионной среде, например, взвесь крахмала, глины и др. в воде. Эмульсиями называют дисперсионные системы двух несмешивающихся жидкостей, где капельки одной жидкости во взвешенном состоянии распределены в объёме другой жидкости. Например, масло, бензол, толуол в воде или капельки жира (диаметром от 0,1 до 22 мк) в молоке и др.
63 Высокомолекулярные соединения обладают специфическим комплексом физико-химических и механических свойств. Важнейшие из них: 1) способность образовывать высокопрочные анизотропные волокна и пленки (см. Ориентированное состояние, Пленки полимерные); 2)способность к большим обратимым, так называемым высокоэластическим, деформациям (см. Высокоэластическое состояние); 3) способность набухать перед растворением и образовывать высоковязкие растворы (см. Растворы полимеров). Эти свойства обусловлены высокой молекулярной массой высокомолекулярных соединений, цепным строением макромолекул, их гибкостью и наиболее полно выражены у линейных высокомолекулярных соединений. По мере перехода от линейных цепей к разветвленным, редким трехмерным сеткам и, наконец, к частым сетчатым структурам комплекс характерных свойств высокомолекулярных соединений становится все менее выраженным. Трехмерные высокомолекулярные соединения с очень большой частотой сетки нерастворимы, неплавки и неспособны к высокоэластичным деформациям.
Высокомолекулярные соединения (полимеры), характеризуются молекулярной массой от нескольких тысяч до нескольких (иногда многих) миллионов. В состав молекул высокомолекулярных соединений (макромолекул)входят тысячи атомов, соединенных химическими связями. Любые атом или группа атомов, входящие в состав цепи полимера или олигомера, называются составным звеном. Наименьшее составное звено, повторением которого может быть описано строение регулярного (см. ниже) полимера, называется составным повторяющимся звеном. Составное звено, которое образуется из одной молекулы мономера при полимеризации, называется мономерным звеном (ранее иногда называлось элементарным звеном). Например, в полиэтилене [—СН2СН2—]n повторяющееся составное звено - СН2, мономерное -СН2СН2.
Растворы высокомолекулярных соединений нмеют значительную вязкость, которая быстро возрастает с увеличением коицеитрации растворов. Повышение концентрации макромолекулярных растворов, добавки веществ, понижающих растворимость полимера, и, часто, понижение температуры приводят к застудневанию, т. е. превращению сильно вязкого, но текучего раствора в сохраняющий форму твердообразный студень. Растворы полимеров с сильно вытянутыми макромолекулами застудневают ири небольшой коицеитрации раствора. Так, желатин и агар-агар образуют студии и гели в 0,2—1,0% растворах. Высушенные студни способны вновь набухать (существенное отличие от гелей)
64. НАБУХАНИЕ - процесс, предшествующий растворению высокомолекулярных соединений, связанный с односторонним проникновением растворителя в образец полимера и раздвиганием молекул. При набухании происходит увеличение объема образца полимера. Неограниченное набухание сопровождается переходом макромолекул в раствор. Ограниченное набухание не переходит в растворение. Растворение аморфных полимеров рассматривают как про цесс смешения двух жидкостей; это подтверждается и сопоставлением теплот растворения полимеров с теплотами смешения жидкостей. Для растворения кристаллических веществ требуется затратить дополнительную энергию для разрушения кристаллической решетки, что значительно изменяет величину теплоты растворения. Действительно, растворение кристаллических полимеров проходит значительно труднее и требует большей затраты энергии. Растворимость кристаллических полимеров уменьшается с повышением температуры плавления кристаллитов. Многие кристаллические полимеры (полиэтилен, политетрафторэтилен, поливини-лиденхлорид) удается перевести в раствор только при температуре, близкой к температуре Вязкость растворов высокомолекулярных соединений зависит как от концентрации, так и от их молекулярного веса; при одинаковой концентрации растворов вязкость повышается с увеличением молекулярного веса полимера. Вязкость является важной технической характеристикой и в значительной мере обусловливает области применения полимерных продуктових плавления. Нарушение устойчивости растворов. ВМС. Устойчивость растворов ВМС нарушается с понижением температуры ниже критической или при добавлении осадителя—жидкости, в которой полимер не растворяется, что приводит к ограниченной растворимости илн нерастворимости. Растворимость при добавлении осадителя зависит от молекулярного веса полимера. В растворах полидисперсных полимеров, имеющих цепи разной длины, постепенное добавление осадителя вызывает выделение фракций в порядке убывания молекулярного веса.
Студни (гели) - структурированные гомогенные системы, заполненные жидкостью, каркас которых образован молекулами высокомолекулярных соединений. В настоящее время термин «Студни» вытесняется более общим понятием «Гели». Студни похожи по свойствам на коллоидные гели, в частности характеризуются отсутствием текучести, способностью сохранять форму, прочностью и упругостью. Эти свойства обусловлены наличием пронизывающей весь объём студня пространственной сетки макромолекул.Однако, в отличие коллоидных гелей, сечение сплошной пространственной сетки имеет молекулярные размеры и она образована не вандерваальсовыми, а химическими или водородными связями. Таким образом, основное отличие студней от коллоидных гелей состоит в том, что это гомогенные, а не дисперсные системы.Студни получаются благодаря действию молекулярных сил сцепления между макромолекулами органических полимеров, например, каучука, желатина, поливинилацетата и др. Эластичные студни, набухая или теряя растворитель, легко и обратимо изменяют свой объем. Т.к. поглощение растворителя значительно увеличивает объем студня, то их называют также набухающими гелями.
65. Истинные растворы ВМС по своим свойствам резко отличаются от растворов низкомолекулярных соединений:
1) Осмотическое давление растворов ВМС не подчиняется закону Вант-Гоффа.Обычно экспериментально определенное значение осмотического давления растворов ВМС значительно выше значения, рассчитанного по уравнению Вант-Гоффа. Объясняется это тем, что макромолекула благодаря своей гибкости ведет себя в растворе как несколько более коротких молекул. При повышении концентрации возрастает число сегментов макромолекулы, которые ведут себя независимо друг от друга. Для вычисления осмотического давления растворов ВМС предложено следующее уравнение:  где b – константа, зависящая от природы растворителя.
где b – константа, зависящая от природы растворителя.
2) Скорость диффузии макромолекул полимера невелика, она сопоставима со скоростью диффузии типичных коллоидных частиц. Для расчета коэффициента диффузии ВМС применимо уравнение Эйнштейна.
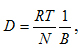 где В – коэффициент трения диффундирующих частиц данной формы.
где В – коэффициент трения диффундирующих частиц данной формы.
Для сферических частиц В=6πηr. Однако макромолекулы ВМС редко имеют форму, близкую к сферической. 3) Растворы ВМС способны рассеивать свет, хотя и в меньшей степени, чем типичные коллоидные системы. Однако цепные молекулы полимеров обычно не могут быть обнаружены в ультрамикроскоп. Это связано с тем, что макромолекулы соизмеримы с коллоидными частицами только по длине, а в других направлениях соответствуют размерам обычных молекул. 4) Растворы ВМС обладают высокой вязкостью. Только очень разбавленные растворы подчиняются законам Ньютона и Пуазейля. Штаудингер установил эмпирическую зависимость между удельной вязкостью раствора (ηуд.), молярной массой растворенного полимера (М) и концентрацией полимера в растворе (с): ηуд = К М с, где К – постоянная. (уравнение Штаудингера)
Онкотическое давление) — коллоидно-осмотическое давление, доля осмотического давления, создаваемая высокомолекулярными компонентами раствора. В плазме крови человека составляет лишь около 0,5 % осмотического давления (3—4 кн/м², или 0,03—0,04 атм). Тем не менее онкотическое давление играет важнейшую роль в образовании межклеточной жидкости, первичной мочи и др. Стенка капилляров свободно проницаема для воды и низкомолекулярных веществ, но не для белков. Скорость фильтрации жидкости через стенку капилляра определяется разницей между онкотическим давлением белков плазмы и гидростатическим давлением крови, создаваемым работой сердца. На артериальном конце капилляра солевой раствор вместе с питательными веществами переходит в межклеточное пространство. На венозном конце капилляра процесс идёт в противоположном направлении, поскольку венозное давление ниже онкотического давления. В результате в кровь переходят вещества, отдаваемые клетками. При заболеваниях, сопровождающихся уменьшением концентрации в крови белков (особенно альбуминов), онкотическое давление снижается, и это может явиться одной из причин накопления жидкости в межклеточном пространстве, в результате чего развиваются отёки.
66. Из 92 имеющихся в природе химических элементов 81 присутствует в организме человека. Минеральные вещества входят в состав всех жидкостей и тканей. Регулируя более 50 000 биохимических процессов, они необходимы для функционирования мышечной, сердечно-сосудистой, иммунной, нервной и других систем; принимают участие в синтезе жизненно важных соединений, обменных процессах, кроветворении, пищеварении, нейтрализации продуктов обмена; входят в состав ферментов, гормонов (йод в состав тироксина, цинк – инсулина и половых гормонов), влияют на их активность. В зависимости от содержания в организме человека минеральные вещества подразделяются на макро- и микроэлементы.Макроэлементы – вещества, содержание которых превышает 0,01% массы тела. Микроэлементы – вещества, концентрация которых в организме равна или менее 0,01% массы тела (от 0,01 до 0,000000000001%). Микроэлементы с содержанием ниже 10-5% (золото, ртуть, уран, радий и др.) относят к ультрамикроэлементам («следовые элементы» (trace elements) в немецко- и англоязычной литературе, «олигоэлементы» – во франкоязычной литературе). В.И. Вернадский в своих трудах называет их «рассеянными элементами». В организме здорового человека присутствуют 12 макроэлементов (C, H, O, N, Ca, Cl, F, K, Mg, Nа, P, S) и 69 микроэлементов. При этом у взрослого содержание кальция в среднем составляет более 1200г, фосфора – свыше 600г, магния – 20г, железа – 3-5г. В костях скелета сосредоточено 99% всего кальция, 87% фосфора и 58% магния. Хлористого натрия особенно много в подкожной жировой клетчатке, железа – в печени, калия – в мышцах, йода – в щитовидной железе. По степени значимости для организма человека макро- и микроэлементы делят на следующие группы:жизненно важные (эссенциальные) элементы – это все макроэлементы (H, O, N, C, Ca, Cl, F, K, Mg, Na, P, S) и 8 микроэлементов (Cr, Cu, Fe, I, Mn, Mo, Se, Zn);жизненно важные, но способные вызвать патологические изменения в организме, находясь в дозах, превышающих норму (условно эссенциальные) микроэлементы (B, Co, Ge, Li, Si, V);потенциально токсичные микроэлементы и ультрамикроэлементы (Ag, As, Au, Br, Ce, Cs, Dy, Er, Eu, Ga, Gd, Hf, Ho, In, Ir, La, Lu, Nb, Nd, Ni, Os, Pd, Pr, Pt, Rb, Re, Rh, Ru, Sb, Sc, Sm, Sn, Sr, Ta, Tb, Te, Th, Ti, Tm, U, W, Y, Yb, Zr);токсичные элементы (Al, Cd, Pb, Hg, Be, Ba, Tl, Вi).

В организме человека литий с пособствует высвобождению магния из клеточных «депо» и тормозит передачу нервных импульсов, тем самым, снижая возбудимость нервной системы, что является важным для лечения различных психических заболеваний. Литий активно влияет на протекающие в мозге нейрохимические процессы. В настоящее время известно, что кроме психотропного действия литий обладает свойствами предупреждать склероз, болезни сердца, в какой-то степени диабет и гипертонию. Он «помогает» магнию оказывать антисклеротическую защиту. Наряду с этим известно, что литий нейтрализует воздействие на организм этанола, радиации, тяжелых металлов. Содержание натрия в теле человека составляет 0,1 — 0,15%. Натрии — один из основных элементов, участвующих в минеральном обмене человека. Всасывание полученного с пищей натрия начинается в желудке и происходит в основном в тонкой кишке. По системе воротной вены всосавшийся натрий поступает в печень, оттуда в небольших количествах в кровь и распределяется по всему внеклеточному пространству. Большая часть натрия в организме находится в динамическом состоянии, обмениваясь между разными частями клетки, между клеткой, внеклеточной жидкостью и смешиваясь с натрием, получаемым с пищей. В организме поддерживается равновесие между потребляемым и выделяемым натрием. Баланс натрия практически равен нулю. Общий обменный натрий составляет 70-83% от всего натрия в организме (43 ммоль/кг - у мужчин, 38 ммоль/кг - у женщин), Натрий является главным внеклеточным ионом. Он играет в организме человека важную биологическую роль. Так, ионы натрия принимают участие в поддерживании постоянного осмотического давления в клетках и кислотно-основного равновесия (рН) в организме.
Калий Биологическая роль и значение калия как биологического элемента исключительно велика, поскольку он необходим для жизнедеятельности и функционирования каждой живой клетки. Одно из главных действий калия в организме — это поддержание нормального функционирования мембран клеток, которые проницаемы для К+. За счет этого внутриклеточная концентрация их значительно выше, чем внутриклеточное количественное содержание Na+. Как указывалось выше, наоборот, в плазме крови концентрация Na+ превышает количественное содержание в ней К+. Этим объясняется возникновение мембранного потенциала клеток. В организме постоянно существует определенное соотношение ионов натрия и калия. Так в плазме крови соотношение ионов натрия и калия составляет 28:1, а в тканях - 1:5. Благодаря этому соотношению поддерживается нормальный ритм мышечной работы. Ионы калия совместно с ионами натрия образуют систему, обеспечивающую проведение биоэлектрических потенциалов в нервах и мышцах. Ионы калия участвуют в регуляции сокращений сердца.предупреждая аритмию, поддерживают осмотическое давление внутри клеток организма, а также регулируют артериальное давление, снимают спазм сосудов
68. В IA группу входят литий, натрий, калий, рубидий и цезий. Эти элементы называют щелочными элементами. В эту же группу входит искусственно полученный малоизученный радиоактивный (неустойчивый) элемент франций. Иногда в IA группу включают и водород (см.главу 10). Таким образом, в эту группу входят элементы каждого из 7 периодов.
Во IIA группу входят бериллий, магний, кальций, стронций, барий и радий. Последние четыре элемента имеют групповое название – щелочноземельные элементы.
Говоря о том, сколь часто встречаются природе атомы того, или иного элемента, обычно указывают его распространенность в земной коре. Под земной корой понимают атмосферу, гидросферу и литосферу нашей планеты. Так, в земной коре наиболее распространены четыре из этих тринадцати элементов: Na (w =2,63 %), K (w = 2,41 %), Mg (w = 1,95 %) и Ca (w = 3,38 %). Остальные встречаются значительно реже, а франций вообще не встречается.Орбитальные радиусы атомов этих элементов (кроме водорода) изменяются от 1,04 А (у бериллия) до 2,52 А (у цезия), то есть у всех атомов превышают 1 ангстрем. Это приводит к тому, что все эти элементы представляют собой элементы, образующие истинные металлы, а бериллий – элемент,образующий амфотерный металл.Общая валентная электронная формула элементов IA группы – ns1, а элементов IIА группы – ns2.Большие размеры атомов и незначительное число валентных электронов приводят к тому, что атомы этих элементов (кроме бериллия) склонны отдавать свои валентные электроны. Наиболее легко отдают свои валентные электроны атомы элементов IA группы (см. приложение 6), при этом из атомов щелочных элементов образуются однозарядные катионы, а из атомов щелочноземельных элементов и магния – двухзарядные катионы. Степени окисления в соединениях у щелочных элементов равна +I, а у элементов IIA группы – +II.Простые вещества, образуемые атомами этих элементов, – металлы. Литий, натрий, калий, рубидий, цезий и франций называют щелочными металлами, так как их гидроксиды представляют собой щелочи. Кальций, стронций и барий называют щелочноземельными металлами. Химическая активность этих веществ увеличивается по мере увеличения атомного радиуса. Из химических свойств этих металлов наиболее важны их восстановительные свойства. Щелочные металлы – сильнейшие восстановители. Металлы элементов IIA группы также довольно сильные восстановители.
69. D-элементы — группа атомов в периодической таблице элементов (d-блок), в электронной оболочке которых валентные электроны с наивысшей энергией занимают d-орбиталь.
Данный блок представляет собой часть периодической таблицы; в него входят элементы от 3 до 12 группы. Элементы данного блока заполняют d-оболочку d-электронами, которая у элементов начинается s2d1 (третья группа) и заканчивается s2d10 (двенадцатая группа). Однако существуют некоторые нарушения в этой последовательности, например, у хрома s1d5 (но не s2d4) вся одиннадцатая группа имеет конфигурацию s1d10 (но не s2d9). Одиннадцатая группа имеет заполненные s- и d-электроны.Элементы d-блока также известны как переходные металлы или переходные элементы. Однако точные границы, отделяющие переходные металлы от остальных групп химических элементов, ещё не проведены. Хотя некоторые авторы считают, что элементы, входящие в d-блок, являются переходными элементами, в которых d-электроны являются частично заполненными либо в нейтральных атомах или ионах, где степень окисления равна нулю. ИЮПАК в данное время принимает такие исследования как достоверные и сообщает, что это относится только к 3—12 группам химических элементов. Металлы 12ой вследствие полного заполнения d-оболочки не соответствуют классическому определению d-элементов, поэтому их можно считать и постпереходными металлами. Также было пересмотрено историческое применение термина «переходные элементы» и d-блока.
Большинство биогенных d-элементов - это микроэлементы. Как составляющие ферментов, гормонов, витаминов и других биологически активных веществ они участвуют в процессах размножения, роста, обмена белков, липидов, углеводов и т.д.. Комплексные соединения, в которых центральным ионом есть элементы вставных декад, а лигандами - аминокислоты, белки и т.д., легко растворяются в воде и хорошо усваиваются живыми организмами. В организме человека как лиганды в биологических комплексов входят белки, аминокислоты и их производные, нуклеиновые кислоты, нуклеопротеиды, азотистые основания, пептиды, жирные кислоты, углеводы, витамины, гетероциклические соединения, желчные кислоты и другие.
Роль d-элементов IB-группы. Применение их соединений в медицине. Медь Си – необходимый микроэлемент живых ор–ганизмов. Серебро Ag и золото Au – примесные мик–роэлементы. Их соединения применяют в медицине. Медь – биогенный элемент, содержится в тканях жи–вотных и растений. Общая масса меди в организме взрослого человека примерно 100 мг, что составляет около 0,0001%. Примерно 30% этого количества содер–жится в мышцах. Печень и мозг также богаты медью. Ме–таллическая медь и ее соединения токсичны. Наиболее важными с физиологической точки зрения являются медьсодержащие белки – цитохромоксидаза и супероксиддисмутаза.
Цитохромоксидаза – один из компонентов дыхатель–ной цепи, локализованной в мембранах митохондрий. Обеспечивает клеточное дыхание, восстанавливая кис–лород до воды на конечном участке дыхательной цепи.Ежедневно организму требуется 2,5—5,0 мг меди. При недостатке в организме меди может развиваться болезнь – медьдефицитная анемия. Медь необходи–ма для усвоения железа, в частности, при синтезе ци-тохромоксидазы, которая содержит и железо, и медь. При дефиците меди нарушается нормальное разви–тие соединительных тканей и кровеносных сосудов.Отравления обычно связаны со случайной передо–зировкой инсектицидов, вдыханием порошка металла, заглатыванием растворов солей меди. Большую опас–ность представляют напитки, хранящиеся в медных сосудах без защитного покрытия стенок.В качестве наружного средства применяют 0,25%-ный водный раствор сульфата меди CuSO4 при воспалении слизистых оболочек и конъюнктивитах. Малые дозы этого препарата могут применяться во время приема пищи для усиления эритропоэза при малокровии.
Серебро В организме взрослого человека обнаружива–ется около 1 мг серебра, т. е. примерно 10% (1 часть на миллион), и до 10 мг золота, т. е. примерно 10% (10 частей на миллион).Антисептические свойства растворимых солей сереб–ра известны с древних времен. Священнослужители дав–но знали, что вода («святая») при хранении в серебряных сосудах долго не портится, т. е. не подвергается микроб–ному загрязнению. В настоящее время это свойство «се–ребряной» воды используется моряками в дальних пла–ваниях. Сильные токсические проявления у взрослого человека наблюдаются при приеме внутрь 7 г AgNO3.
В медицине издавна используются такие препараты, как кристаллический нитрат серебра AgN03 (ляпис) и его водные растворы. Давно известны также препараты кол–лоидного металлического серебра протаргол (8% Ag) и колларгол (70% Ag), которые представляют собой мелкодисперсные порошки с металлическим блеском. Каждая частица таких порошков представляет собой кристаллик восстановленного металлического серебра размером менее 1 мкм с белковой оболочкой из альбу–мина (протаргол) или коллагена (колларгол). Белковая оболочка защищает кристаллики серебра от слипания и обеспечивает их переход в водную среду (солюбилизирует).
Препараты серебра применяют как противовоспали–тельные, антисептические и вяжущие средства.
 2018-01-21
2018-01-21 1957
1957
