1. Из термодинамики следует, что самопроизвольно могут протекать только такие процессы в результате которых свободная энергия системы убывает


Т.к. Еиn=const, то ОВР может протекать самопроизвольно если ЭДС системы больше 0
Если условия станд., то можно сравнить станд. Потенциалы. В нест. Условиях, когда [Ox]~[Red]  1 моль/л, то потенциалы необходимо рассчитать по ур. Нернста.
1 моль/л, то потенциалы необходимо рассчитать по ур. Нернста.
2.


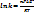 при Т=298К
при Т=298К 
Законы Фарадея:
1. Масса в-вапрореагировавшего на электроде пропорционально кол-ву протекшего вещ-ва.
m=QQ=I*t
q-электрохим. Эквивалент
2.q -это теоретическая масса вещ-ва, которая реагирует на электроде при прохождении через него 1 Фарадея эл-ва.
 =
= 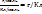
m= 
Вт- Выход по току, учитывает кол-во эл-ва, пошедшего на данную реакцию, если на электроде одновременно протекает 2 или более реакции.
Вт=  *100%
*100%
V= 
m= 
Э= 
Гальванические первичные элементы - это устройства для прямого преобразования химической энергии, заключенных в них реагентов (окислителя и восстановителя), в электрическую. Реагенты, входящие в состав источника, расходуются в процессе его работы, и действие прекращается после расхода реагентов. Примером гальванического элемента является элемент Даниэля –Якоби.
(-) Zn|ZnSO4||GuSO4||Cu (+)
Широкое распространение получили марганцево-цинковые элементы, не содержащие раствора электролита (сухие элементы, батарейки). Так, в солевых элементах Лекланше цинковый электрод служит анодом, электрод из смеси диоксида марганца с графитом служит катодом, графит служит токоотводом. Электролитом является паста из раствора хлорида аммония с добавкой муки или крахмала в качестве загустителя
(-) |NH4Cl|MnO2 (+)
.Щелочные марганцево-цинковые элементы, в которых в качестве электролита используется паста на основегидроксида калия, обладают целом рядом преимуществ, в частности существенно большей ёмкостью, лучшей работой при низких температурах и при больших токах нагрузки.Солевые и щелочные элементы широко применяются для питания радиоаппаратуры и различных электронных устройств.
топливные элементы - это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электродые не расходуются. Восстановителем является водород (H2), метанол (CH3OH), метан (CH4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.
(-) Pb|H2SO4|PbO2 (+)
Электролиз -это процесс в котором энергия постоянного электрического тока преобразуется во втутр. Энергию не самопроизвольной ОВР
В кач-ве нерастворимых анодов используются оксидные электроды(PbO2, ORTA(окись рутения),MnO2,C,Pt)
Электролиз р-раNaClcинертным анодом
(-) Fe|NaCl|ORTA (+)

2H2O+2 
 2
2 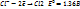
2H2O-4 
2H20+ 
2H2O+NaCl 
 2018-01-21
2018-01-21 437
437







