Что называют осмосом и осмотическим давлением? От каких факторов зависит осмотическое давление и каким уравнением эта зависимость выражается?
При растворении уменьшается концентрация свободных молекул воды, поскольку вода входит в гидратные оболочки растворенных веществ. Если соединить два раствора с разной концентрацией веществ, например сахара, через полупроницаемую перегородку, то в силу разной концентрации будет происходить переток воды из области меньшей концентрации вещества. Этот переток воды обусловлен гидратацией сахара и нехваткой свободной воды в зоне с большей концентрацией. Переток молекул воды через полупроницаемую перегородку называется осмосом, а дополнительное гидростатическое давление на перегородку осмотическим давлением.
Осмотическое давление зависит от концентрации. А кинетическое движение молекул зависит от температуры, чем выше температура, тем выше переток, т.е. осмос. Значит и осмотическое давление зависит от температуры. Эта зависимость носит название закона Вант-Гоффа и имеет вид:
Росм=СМ×R×T.
Осмотическое давление раствора неэлектролита прямо пропорционально молярной концентрации и абсолютной температуре.
Дайте формулировку и математическое выражение законов Рауля. Какие два следствия вытекают из закона Рауля, определяющие температуры кипения и замерзания растворов нелетучих веществ?
Понижение давления пара раствора. Первый закон Рауля.
На границе раздела фаз (жидкость-газ) происходят два явления – испарение-конденсация. Молекулы растворителя испаряясь, переходят в газообразную фазу и создают определенное давление водяных паров над растворителем. Конденсируясь в жидкость, пары уменьшают давление. Наконец при определенной температуре (250С или 2980К) наступает равновесие испарение-конденсация и давление водяных паров (т.е. растворителя) будет постоянным. Обозначим его через Р0. Если растворить при той же температуре какой-то нелетучий неэлектролит (например, сахар), то гидратированные молекулы сахара, распределяясь в объеме и на поверхности раствора, закроют поверхность испарения. И площадь испарения воды уменьшится. Т.е. за тот же промежуток времени и при той же температуре с поверхности раствора испарится меньше молекул воды и давление пара уменьшится. Таким образом, давление пара раствора всегда меньше давления чистого растворителя. Обозначим давление пара раствора через – Р. Разность давлений «Р0-Р», отнесенная к давлению чистого растворителя Р0 – называется относительное понижение давления пара раствора, т.е. –
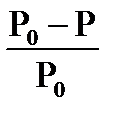
Оно зависит от концентрации растворенного вещества, чем его больше, тем больше понижение.
I закон Рауля: для разбавленных растворов неэлектролитов относительное понижение давления пара раствора равно мольной доле нелетучего растворенного вещества:
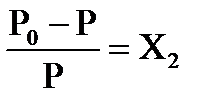
Понижение t0 замерзания и повышение t0 кипения растворов неэлектролитов - II закон Рауля
Dt0к=Е×b
Dt0з=K×b,
где Dt – повышение (понижение) температуры,
Е – эбулиоскопическая (выкипать) константа,
К – криоскопическая (замерзать) константа,
b – моляльная концентрация растворенного вещества.
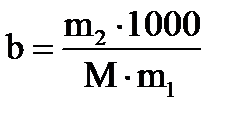
где m2 и m1 - масса растворенного вещества и растворителя,
М - молярная масса растворенного вещества, 1000 – масса воды.
Закон имеет вид:
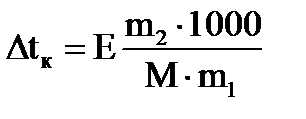 (эбулиоскопический метод)
(эбулиоскопический метод)
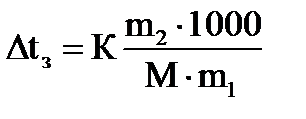 (криоскопический метод)
(криоскопический метод)
Повышение температуры кипения (понижение температуры замерзания) растворов прямо пропорционально моляльной концентрации растворенного вещества. По II закону Рауля можно определять молекулярные массы неизвестных веществ.
 2018-01-21
2018-01-21 628
628








