Электроды сравнения, электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью измерения абсолютного величины потенциала отдельного электрода. В принципе в качестве электрода сравнения может служить любой электрод в термодинамически равновесном состоянии, удовлетворяющий требованиям воспроизводимости, постоянства во времени всех характеристик и относит, простоты изготовления.
Для водных электролитов наиболее часто применяют в качестве электроды сравнения водородный, каломельный, галогеносеребряные, оксидно-ртутный и хингидронный электроды.
Водородный электроды сравнения представляет собой кусочек платиновой фольги или сетки, покрытый слоем электролитической Pt и погруженный частично в раствор, через который пропускают Н2. При адсорбции на электроде образуются адсорбированные атомы Надс. Электродные реакции на водородном электроды сравнения описываются уравнениями: Н2  2Надс
2Надс  2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода р Н2 равном 1 атм (1,01 х 105 Па), термодинамической активности ионов водорода в растворе а Н+, равной 1, называют стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Дня водородного электроды сравнения уравнение Нернста записывается в виде:
2Н+ + 2е (е - электрон). Водородный электрод при давлении водорода р Н2 равном 1 атм (1,01 х 105 Па), термодинамической активности ионов водорода в растворе а Н+, равной 1, называют стандартным водородным электродом, а его потенциал условно принимают равным нулю. Потенциалы других электродов, отнесенные к стандартному водородному электроду, составляют шкалу стандартных электродных потенциалов (см. Стандартный потенциал). Дня водородного электроды сравнения уравнение Нернста записывается в виде:
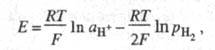
где Т - абс. температура; F - постоянная Фарадея. R - газовая постоянная. При р Н2 = 1 атм электродный потенциал

Используется в широком диапазоне рН – от значений, соответствующим концентрированным кислотам, до значений, соответствующим концентрированным щелочам. Однако в нейтральных растворах водородный электроды сравнения может нормально функционировать лишь при условии, что раствор обладает достаточно хорошими буферными свойствами. Это связано с тем, что при установлении равновесного потенциала на платинированной платине, а также при пропускании тока через водородный электроды сравнения появляется (или исчезает) некоторое количество ионов Н+, то есть изменяется рН раствора, что особенно заметно в нейтральных средах. Водородный электрод применяют в широком интервале температур, отвечающем существованию водных растворов. Следует, однако, учитывать, что при повышении температуры парциальное давление водорода падает вследствие роста давления паров растворителя и обусловленное этим изменение потенциала электроды сравнения соответствует уравнению
 , где р - барометрич. давление (в кПа), a ps - суммарное давление насыщенных паров над раствором (кПа). Возможность использования водородного электрода в органических средах требует специальной проверки, так как Pt может катализировать процессы с участием органических соединений, вследствие чего нарушается равновесие электродной реакции и электрод приобретает стационарный потенциал, отличный от равновесного.
, где р - барометрич. давление (в кПа), a ps - суммарное давление насыщенных паров над раствором (кПа). Возможность использования водородного электрода в органических средах требует специальной проверки, так как Pt может катализировать процессы с участием органических соединений, вследствие чего нарушается равновесие электродной реакции и электрод приобретает стационарный потенциал, отличный от равновесного.
 2018-01-21
2018-01-21 767
767








