Тема 1. Теорія будови органічних сполук
Лекція 1.
Електронна природа хімічних зв’язків в органічних сполуках
Визначення:
Органічна хімія – розділ хімії, предметом якого є хімія сполук карбону, їхня будова, властивості, методи добування і можливості практичного застосування.
Особливості органічних сполук:
1. Велика кількість (декілька мільйонів)
2. Органічні сполуки менш стійкі ніж неорганічні
3. Хімічні реакції між органічними сполуками ідуть не так швидко, як між неорганічними
4. Кристалічні гратки молекулярні, легкоплавкі, мають запах
5. Елементи органічних сполук як правило мають сталі валентності
6. Органічні сполуки утворюють ряди, які подібні за хімічними властивостями – гомологічні ряди
Гомологічний ряд – ряд, в якому кожна наступна сполука відрізняється від попередньої на гомологічну одиницю.
Приклад: Гомологічний ряд насичених вуглеводнів
Загальна формула: СnH2n+2
CH4 метан
CH3-CH3 етан
CH3-CH2-CH3 пропан
Гомологічна різниця: -CH2-
Радикал – це реакційно здатна частина, яка має невикористану валентність 1е-. Загальна формула: СnH2n+1
Таблиця радикалів
| метил | H3C- |
| етил | H3C-CH2- |
| пропил | 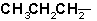
|
| ізопропил | 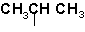
|
| н-бутил | 
|
| вторинний бутил | 
|
| первинний бутил (ізобутил) | 
|
| третинний бутил | 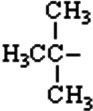
|
| вініл | H2С=CH- |
| неопентил | 
|
| фініл | 
|
| бензил | 
|
7. Для органічних сполук характерне явище ізомерії, яке обумовлює різноманітність сполук у природі
Ізомери – речовини, які мають однаковий кількісний та якісний склад, але різну будову молекул, тому мають різні властивості.
8. Органічні сполуки є тим матеріалом, із якого побудовані організми рослин, тварин, а також вони входять до складу їжі
Формули, якими користуються в органічній хімії
1. Молекулярна (кількісний та якісний склад)
2. Полуструктурна порядок зв’язку атомів
3. Структурна у молекулі
4. Електронна (показ механізму реакцій)
Номенклатура в органічних сполуках.
Лекція 2.
Женевська номенклатура була прийнята в 1892 році.
IUPAC:
1) Головний ланцюг повинен включати кратний зв'язок.
2) Нумерацію визначає кратний зв'язок.
3) Положення кратного зв’язку вказується цифрою наприкінці назви.
4) Якщо речовина містить галоген(або інший замісник), то його положення вказується в першу чергу.
Ароматичні вуглеводні
Головний ланцюг повинен включати ароматичне кільце. Нумерування по годинній стрілці.
Спирти
1)Нумерацію в спиртах визначає функціональна група ОН. Мають закінчення «ол».
2)Положення ОН вказується цифрою на кінці назви.
3)Якщо в речовині є замісник, то його положення вказується в першу чергу.
 Альдегіди
Альдегіди
1) Завжди мають функціональну групу, вона визначає нумерацію.
 Карбонові кислоти.
Карбонові кислоти.
2) Карбоксильна група має закінчення «ова», визначає нумерацію.
Теорія будови органічних сполук Бутлерова
А. М. Бутлеров стверджував, що кожній речовині відповідає одна хімічна формула, яка характеризує усі хімічні властивості речовини, реально відображає порядок хімічного зв’язку атомів в молекулах. Також він вважав, що за допомогою хімічних методів аналізу та синтезу речовини, можна встановити хімічну будову сполуки та навпаки.
Основні положення теорії Бутлерова
1) Атоми розташовані в молекулах не хаотично, а з’єднані один з одним в визначеній послідовності у відповідності з їх валентністю.
2) Хімічні властивості речовин залежать не тільки від якісного та кількісного складу, але й від хімічної будови молекул.
3) Атоми або групи атомів у молекулах взаємно впливають один на одного, безпосередньо або за допомогою інших атомів, від цього залежить реакційна здатність молекули
Наслідки теорії Бутлерова
1) Карбон завжди 4х валентний
2) Карбон взаємодіє з металами та неметалами, так як займає проміжне місце у таблиці.


3) Карбон може утворювати різні ланцюги: лінійні, розгалужені, циклічні.
4) Для карбону характерне явище гібридизації – змішування різних валентних орбіта лей з наступним вирівнюванням їх за формою та енергією.
 sр3-гибридизация:
sр3-гибридизация:
sр2-гибридизация: 
 sр-гибридизация:
sр-гибридизация:
Лекція 3.
 2018-01-21
2018-01-21 694
694







