На примере латуни – сплава Zn – Cu
1. Коррозия латуни в кислой среде:
A (-) Zn | HCl | Cu (+) K
Анодный процесс: Zn – 2e = Zn2+ - окисление
Катодный процесс: 2H+ + 2e = H2 – восстановление
Перетекание электронов с анодных участков на катодные называется катодной поляризацией. Снятие электронов с катодных участков ионами водорода называется водородной деполяризацией, а ионы водорода – деполяризаторами. В кислых средах, не содержащих растворённого кислорода, коррозия протекает только с водородной деполяризацией. Данное уравнение будет выглядеть так:
Zn + 2H+ = Zn2+ + H2↑
Zn + 2HCl = ZnCl2 + H2↑
Продукты коррозии: ZnCl2 и H2↑. Хлорид цинка - растворимая в воде соль, значит, поверхность металла она не защищает, и растворение цинка идёт до конца. Поэтому латунные изделия нельзя эксплуатировать в кислой среде.
2. Коррозия латуни во влажной атмосфере воздуха (нейтральная среда):
A (-) Zn | Н2O, O2 | Cu (+) K
Анодный процесс: Zn – 2e = Zn2+ (х2)
Катодный процесс: 2H2O + O2 + 4e = 4OH–
2Zn + 2H2O + O2 = 2Zn2+ + 4OH–
2Zn + 2H2O + O2 = 2Zn(OH)2↓
Латунные изделия можно эксплуатировать во влажной атмосфере воздуха, так как образуется нерастворимое соединение, защищающее поверхность от дальнейшей коррозии. Процесс идёт с кислородной деполяризацией.
Электрохимическая коррозия при контакте
двух металлов Al – Cu:
A (-) Al | Н2O | Cu (+) K
Анодный процесс: Al – 3e = Al3+ (х2)
Катодный процесс: 2H2O + 2e = H2 + 2OH– (х3)
2Al + 6H2O = 2Al3+ + 3H2 + 6OH–
2Al + 6H2O = 2Al(OH)3↓ + 3H2
Процесс идёт с водородной деполяризацией.
Основной причиной электрохимической коррозии является термодинамическая неустойчивость металла в данной среде. Чтобы процесс не шёл самопроизвольно, мы должны выбрать такой металл, для которого EK < EA.
Классификация металлов по их термодинамической неустойчивости в наиболее распространённых
Коррозионных средах
1.Кислая среда (без кислорода).
Катодный процесс: 2H+ + 2e = H2, EK = 0, ΔE > 0, EA < 0, т. е. в кислой среде по ряду напряженияй металлов будут подвергаться коррозии Li – W.
2.Нейтральная среда (без кислорода).
Катодный процесс: H2O + 2e = H2 + 2OH–, 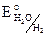 = – 0,41 B. Т. е. во влажной атмосфере подвергаются коррозии металлы от Li – Fe по ряду напряжений металлов.
= – 0,41 B. Т. е. во влажной атмосфере подвергаются коррозии металлы от Li – Fe по ряду напряжений металлов.
3.Нейтральная среда (с растворённым кислородом).
Катодный процесс: 2H2O + O2 + 4e = 4OH–, 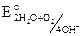 = 0,815 B. Т. е. в нейтральной среде будут корродировать металлы Li – Ag по ряду напряжений металлов.
= 0,815 B. Т. е. в нейтральной среде будут корродировать металлы Li – Ag по ряду напряжений металлов.
4.Кислая среда (с растворенным кислородом).
Катодный процесс: 4H+ + O2 + 4e = 2H2O, 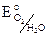 = 1,23 B. Металлы, имеющие меньший электродный потенциал Li – Hg будут корродировать в кислой среде в присутствии кислорода.
= 1,23 B. Металлы, имеющие меньший электродный потенциал Li – Hg будут корродировать в кислой среде в присутствии кислорода.
 2018-01-21
2018-01-21 3680
3680








