Термохимия – раздел химии, посвященный количественному изучению тепловых эффектов реакций.
Тепловой эффект химического процесса – изменение энтальпии, произошедшее при осуществлении этого процесса, отнесенное к одному молю вещества или одному молю эквивалентов вещества.
Величина теплового эффекта зависит от природы исходных веществ и продуктов реакции, их агрегатного состояния и температуры.
Два способа записи термохимических уравнений:
· Термодинамический
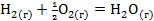 ∆Н=-242 кДж
∆Н=-242 кДж
· Термохимический
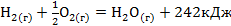
Термохимия рассматривает, сколько энергии приобрела или отдала окружающая среда. Термодинамика указывает изменение энергии, происходящее в самой реакции.
Энтальпия – теплосодержание системы.
Экзотермические реакции – реакции с выделением теплоты. 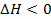
Эндотермические – реакции, протекающие с поглощением теплоты. 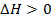
Стандартным состоянием вещества называют такое его агрегатное состояние, которое наиболее устойчиво при стандартных условиях (т.е. обладает наименьшей энергией(энтальпией)).
Изменение энтальпии может характеризовать не только реакцию, но и химическое соединение, полученное в этой реакции.
Стандартная энтальпия образования одного моля соединения из простых веществ в их стандартных состояниях при стандартных условиях называется стандартной энтальпией образования данного соединения. 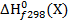
Закон Лавуазье-Лапласа: тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
Закон Гесса: т епловой эффект реакции зависит только от начального и конечного состояния реагирующих веществ, но не зависит от промежуточных стадий реакций, то есть от способа проведения процесса (при изобарном и изохорном процессах).
Следствие из закона Гесса: и зменение энтальпии в ходе реакции равно сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учетом стехиометрии этой реакции.
aA+bB=cC+dD
A, B – реагенты; C, D – продукты реакции; a, b, c, d – стехиометрические коэффициенты.
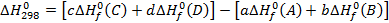 .
.
 2018-01-21
2018-01-21 2322
2322
