Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, а также возможность и направление самопроизвольного протекания процессов.
Системой называется тело или группа тел, находящихся во взаимодействии с окружающей средой и мысленно обособляемых от нее.
Внутренняя энергия – это такая форма энергии, скрытая в веществах и частично освобождающаяся при химических и некоторых физических процессах.
Для системы, неподверженной действию внешних сил и находящейся в состоянии макроскопического покоя, внутренняя энергия представляет собой полную энергию системы.
Внутренняя энергия вещества – это кинетическая и потенциальная энергия частиц, за вычетом потенциальной и кинетической энергии системы как целого.
Внутренняя энергия системы равна сумме кинетической энергии движения атомов, потенциальной энергии хранящейся в химических связях и гравитационной энергии системы
Внутренняя энергия системы зависит от природы вещества ее компонентов, массы и параметров состояния системы.
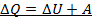 – первый закон термодинамики:
– первый закон термодинамики:
Теплота, подведенная к системе, расходуется на изменения внутренней энергии системы и на совершение работы против внешних сил.
Изменение внутренней энергии определяется только начальным и конечным состояниями системы, то есть является функцией состояния системы.
Величина работы зависит от вида процесса и не является функцией состояния системы.
Теплота не является функцией состояния, но в различных процессах она связана с функциями состояния.
При изохорном процессе 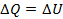 Вся подводимая теплота идет на изменение внутренней энергии системы.
Вся подводимая теплота идет на изменение внутренней энергии системы. 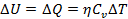
В случае химической реакции, протекающей без изменения объема системы, изменение внутренней энергии равно взятому с обратным знаком тепловому эффекту этой реакции.
При изотермическом процессе 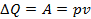
При адиабатном процессе 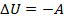 , то есть работа совершается за счет убыли внутренне энергии системы.
, то есть работа совершается за счет убыли внутренне энергии системы.
При изобарном процессе 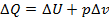
H=U+pv – энтальпия системы
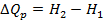
Теплота расходуется на изменение энтальпии системы
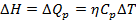
Энтальпия характеризует энергетическое состояние вещества и включает энергию, затрачиваемую на преодоление внешнего давления, то есть на работу расширения.
Энтальпия определяет состояние системы и не зависит от того, каким путем это состояние достигнуто.
Энтальпия идеального газа зависит только от его абсолютной температуры и пропорциональна массе газа.
 2018-01-21
2018-01-21 2633
2633