Периодического закон: свойства элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядра.
Изменение свойств химических элементов по мере возрастания их атомной массы не совершается непрерывно в одном и том же направлении, а имеет периодический характер.
Порядковый номер элемента в периодической системе равен заряду ядра, или количеству протонов в нем, а также количеству электронов в оболочке нейтрального атома.
Периоды – горизонтальные ряды элементов с одинаковым максимальным значением главного квантового числа валентных электронов. Каждый период начинается типичным металлом и завершается благородным газом.
Номер периода обозначает число энергетических уровней в атоме элемента.
Металлические свойства – способность атомов отдать электрон.
Неметаллические свойства – способность присоединять электроны.
Номер группы совпадает с числом валентных электронов элемента.
А-подгруппы состоят из элементов малых и больших периодов, валентные электроны которых расположены на внешних ns- и np- подуровнях. Сверху вниз металлические свойства усиливаются.
Б-подгруппы состоят из элементов только больших периодов. Их валентные электроны находятся на внешнем ns- подуровне и внутреннем (n-1)d- или (n-2)f- подуровнях.
Вследствие волновой природы электрона атом не имеет строго определенных границ. Радиусы атомов и ионов являются условными величинами. Чем больше атомный радиус, тем слабее удерживаются внешние электроны.
В подгруппах с увеличением порядкового номера атомный радиус возрастает.
В периодах атомные радиусы уменьшаются из-за роста силы притяжения электронов с увеличением заряда ядра.
Энергия ионизации (I) – энергия, которую необходимо затратить для отрыва электрона от атома, находящегося в нормальном состоянии. Это количественная мера связи электрона с ядром. Измеряется в кДж/моль или в электронвольтах (эВ).
Отрыв второго электрона происходит труднее, чем первого, т.к. второй электрон отрывается не от нейтрального атома, а от положительного иона. Поэтому второй потенциал ионизации I2больше, чем первый (I2>I1).
Чем меньше I, тем сильнее выражены металлические свойства, а также основный характер соединений.
В периодах слева направо энергия ионизации увеличивается.
В подгруппах сверху вниз I уменьшается.
Сродство атома к электрону (A) – энергия, выделяющаяся или поглощающаяся при присоединении электрона к нейтральному атому. Измеряется в кДж/моль или в электронвольтах (эВ).
Сродство к электрону возрастает по периоду, а в подгруппах уменьшается.
Электроотрицательность характеризует способность атомов оттягивать от других атомов электроны при образовании химической связи.
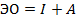 – абсолютная ЭО
– абсолютная ЭО
В периодах слева направо ЭО возрастает; в подгруппах сверху вниз – уменьшается.
Чем сильнее ЭО атома, тем сильнее притягивает общую электронную пару.
ЭО показывает металлический или неметаллический характер того или иного элемента. Чем меньше ЭО, тем более сильные восстановительные свойства элемента и наоборот.
 2018-01-21
2018-01-21 2365
2365
