Чем более электроотрицателен элемент, тем более делокализован заряд и тем стабильнее анион.
С (2,5) N (3,0) S (2,5)
Поэтому кислотность изменяется в ряду СН< NН < ОН
Для SH – кислот преобладает другой фактор – поляризуемость.
Атом серы больше по размеру и имеет вакантные d – орбитали. следовательно, отрицательный заряд способен делокализоваться в большом объеме, что приводит к большей стабильности аниона.
Тиолы, как более сильные кислоты, реагируют с щелочами, а также с оксидами и солями тяжелых металлов, тогда, как спирты (слабые кислоты) способны реагировать только с активными металлами
 2RОН + 2Nа 2R – ОNа + Н2
2RОН + 2Nа 2R – ОNа + Н2
Относительно высокая кислотность толов используется в медицине, в химии лекарственных средств. Например:
СН2 – СН2 – СН – (СН2)4 – СООН CH2 – SH
НS HS CH – SH
дигидролипоевая кислота CH2 – OH+
БАЛ
|
 Cl2As – CH = CHCl
Cl2As – CH = CHCl
люизит
 СН2 – S
СН2 – S
 CH – S As – CH = CHCl то есть БАЛ реагирует SH, но не ОН -
CH – S As – CH = CHCl то есть БАЛ реагирует SH, но не ОН -
CH – OH кислотой
Нетоксичное производное
Итак, при одинаковых R кислотность падает в ряду
SН > OH > NH > CH (SONC)
При оценке кислотности соединений с одинаковым атомом в кислотном центре определяющим фактором является делокализация отрицательного заряда в анионе. Стабильность аниона значительно повышается с появлением возможности делокализации отрицательного заряда по системе сопряженных связей. Значительное увеличение кислотности в фенолах, по сравнению со спиртами объясняется возможностью делокализации в ионах по сравнению с молекулой.
С6Н5О¯ по сравнению R – О¯


 О Влияние этого фактора в пирроле
О Влияние этого фактора в пирроле
 б б (рКа = 17,5)
б б (рКа = 17,5)
б N
σ H
С2Н5 – СН3 < С2Н5NН2 < С2Н5ОН < С2Н5SН < С6Н5ОН < СН3СООН
рКа = 40 рКа» 30 рК = 18 12 10 4,7
Высокая кислотность карбоновых кислот обусловлена резонансной стабильностью карбоксилат аниона

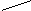
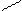
 O O¯ O
O O¯ O


 R – C R – C или R – C —
R – C R – C или R – C —
O O O
Деполяризации заряда способствует наличие электроноакцепторных заместителей (ЭА) они стабилизируют анионы, тем самым увеличивают кислотность. Например, введение в молекулу ЭА заместителя
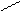
 О О
О О


 СН3 – СН – СН2 СН3 – СН – С
СН3 – СН – СН2 СН3 – СН – С
рКа = 4,9 ОН рКа=3,9 ОН ОН
молочная кислота
a - оксикислоты более сильные кислоты, чем соответствующие карбоновые кислоты.
ЭД – заместители наооброт понижают кислотность. Растворители оказывают большее влияние на стабилизацию аниона, как правило лучше сольватируются небольшие ионы с низкой степенью делокализации заряда.
Влияние сольватации можно проследить например в ряду:

 О О О
О О О

 Н – С СН3 – С СН3 – СН2 – С
Н – С СН3 – С СН3 – СН2 – С
ОН ОН ОН
РКа 3,7 4,7 4,9
С увеличением размера аниона уменьшается кислотность.
Если атом в кислотном центре несет положительный заряд это приводит к усилению кислотных свойств.
Вопрос к аудитории: какая кислота – уксусная или пальмитиновая С15Н31СООН – должна иметь меньшее значение рКа?
Если атом в кислотном центре несет положительных заряд, это приводит к усилению кислотных свойств.
 Н
Н

 СН3 – СН2 – +О Н+ + СН3 – СН2 – ОН рКа = -2,2
СН3 – СН2 – +О Н+ + СН3 – СН2 – ОН рКа = -2,2
Н
 СН3 – СН2 – ОН Н+ + СН3 – СН2 – О¯ рКа = 18
СН3 – СН2 – ОН Н+ + СН3 – СН2 – О¯ рКа = 18
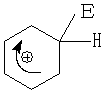
Можно отметить сильную СН – кислотность σ – комплекса, образующегося в реакции электрофильного замещения.
 2014-02-13
2014-02-13 829
829








