Первоначально были предложены две модели атома. Согласно модели Томсона, атом состоит из положительного заряда, равномерно распределенного по всему объему атома, и электронов, колеблющихся внутри этого заряда. Резерфордом в 1911 г. была предложена планетарная модель атома. Согласно этой модели, атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома, и вращающихся вокруг него электронов.
Эта модель первоначально не могла объяснить устойчивость атома, т.к. вращающийся вокруг ядра электрон должен излучать энергию и в конце концов “упасть” на ядро.
Вторым противоречием этой модели была невозможность объяснить линейчатый характер атомных спектров, т.е. излучение атомом электромагнитных волн только с определенными длинами волн.
Постулаты Бора:
1) Электрон может вращаться вокруг ядра не по любым орбитам, а лишь по некоторым определенным (стационарным) орбитам, на которых он не излучает энергии.
2) Ближайшая к ядру орбита соответствует наиболее устойчивому состоянию атома. При сообщении энергии извне электрон может перейти на одну из более удаленных орбит (возбужденное состояние атома).
3) Поглощение и излучение энергии атомом может происходить только при переходе электрона с одной орбиты на другую. Этому излучению соответствует частота колебаний ν, выражаемая уравнением Планка:
hν = Eн – Eк,
где h – постоянная Планка (h=6,62 ⋅10–34Дж⋅с); Ен, Ек – соответственно энергии начального и конечного состояний.
Согласно гипотезе де Бройля любая движущаяся частица может быть охарактеризована длиной волны и частотой, связанной с ее движением.
Соотношение де Бройля 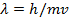 ; m- масса частицы, v – скорость частицы.
; m- масса частицы, v – скорость частицы.
Гипотеза де Бройля получила экспериментальное подтверждение для малых частиц.
С позиции квантовой механики электрон обладает корпускулярно-волновым дуализмом. Это положение лежит в основе квантовой модели строения атома.
Электрон может без потери энергии находиться на тех орбитах, в которых укладывается целое число волн де Бройля.
Область пространства, где наиболее вероятно нахождение электрона, определяет форму электронного облака.
Согласно квантовой механике, движение электрона в атоме описывается волновым уравнением (уравнение Шредингера):
m – масса электрона; U – потенциальная энергия; E – полная энергия электрона; x, y, z – координаты.
Это уравнение связывает энергию электрона с пространственными координатами и волновой функцией.
Решение уравнения Шредингера приводит к необходимости ввести постоянные величины, называемые квантовыми числами.
Состояние электрона в атоме полностью определяют 3 квантовых числа:
· Главное квантовое число (n) – характеризует общий запас энергии и возможные энергетические состояния электрона в атоме, также определяет размеры электронного облака.
Максимальное число электронов, которые могут находиться на том или ином уровне, определяется по формуле: 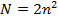 , N- максимальное число электронов на уровне; n – номер энергетического уровня. В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K,L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона).
, N- максимальное число электронов на уровне; n – номер энергетического уровня. В реальных атомах n имеет 7 значений, обозначаемых латинскими буквами K,L, M, N, O, P, Q. Значение n=1 отвечает уровню с самой низкой энергией (т.е. наиболее устойчивому состоянию электрона).
· Орбитальное квантовое число (l) – характеризует запас энергии электрона на энергетическом подуровне и форму электронного облака, которая, как и энергия, не может быть произвольной, также характеризует форму электронного облака.
Форма s-электронного облака. Это облако обладает сферической симметрией, т.е. имеет форму шара. График волновой функции Ψ расположен по одну сторону от оси абсцисс, т.е. волновая функция s-электрона положительна.
Форма p-электронного облака. Для p-электрона при удалении от ядра по некоторому направлению волновая функция имеет перегиб. По одну сторону от ядра Ψ положительна, а по другую – отрицательна. В начале координат Ψ обращается в нуль. В отличие от s-орбитали, p-орбиталь не обладает сферической симметрией, а имеет форму, напоминающую гантель.
Еще более сложную форму имеют электронные облака d- и f-электронов. Например, d-орбитали могут иметь четырехлепестковое строение, причем знаки волновой функции в “лепестках” чередуются
· Магнитное квантовое число (m) – характеризует положение электронного облака в пространстве. Зависит от орбитального квантового числа.
· Спинное квантовое число (s) – не связано с движением электрона вокруг ядра, а определяет его собственное состояние. Предполагается, что она связана с вращением электрона вокруг собственной оси. Принимает только два значения –(1/2) и +(1/2).
| l | m | |
| s | ||
| p | -1, 0, 1 | |
| d | -2, -1, 0, 1, 2 | |
| f | -3, -2, -1, 0, 1, 2, 3 |
 2018-01-21
2018-01-21 2917
2917
