Электролиты – вещества, которые при растворении подвергаются диссоциации на ионы. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда.
Количественная оценка процесса электролитической диссоциации дается двумя величинами: степенью диссоциации α и константой диссоциации K.
Степенью диссоциации (α) электролита называется отношение числа его молекул, распавшихся на ионы, к общему числу молекул электролита в растворе, т. е. α = 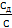 .
.
Степень электролитической диссоциации зависит как от природы растворенного вещества, так и от концентрации раствора, увеличиваясь с его разбавлением.
Электролиты можно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью. К сильным электролитам относятся, например, H2SO4, HCl, HNO3, H3PO4, HClO3, HClO4, KOH, а также хорошо растворимые соли: NaCl, KBr, NH4NO3и др. К слабым электролитам относятся плохо растворимые соли, вода и большинство органических кислот, а также неорганические соединения: H2CO3, H2S, HCN, H2SiO3, H2SO3, HNO2, HClO, HCNO, NH4OH и др.
|
|
|
Константа равновесия для процесса диссоциации называется константой диссоциации (K).
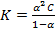 ; С- концентрация электролита, распадающегося на два иона.
; С- концентрация электролита, распадающегося на два иона.
Это уравнение выражает закон разбавления Оствальда. Если электролит слабый, и диссоциация очень мала (α<<1), то этот закон упрощается: K=α2C; 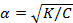 .
.
Таким образом, степень диссоциации возрастает с разбавлением раствора.
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато.
Для ступенчатой диссоциации всегда KI>KII>KIII>…, т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Основания. С точки зрения теории электролитической диссоциации основания-это вещества, диссоциирующие в водном растворе с образованием анионов одного вида - гидроксид - ионов ОН-.
В общем виде уравнение электролитической диссоциации основания имеет вид:
Основание -> Катион основания + Гидроксид - ион
Кислоты. С точки зрения теории электролитической диссоциации кислоты-это вещества, диссоциирующие в водном растворе с образованием катионов одного вида - катионов водорода Н+.
В общем виде уравнение электролитической диссоциации кислоты имеет вид:
Кислота -> Катион водорода + Анион кислотного остатка
Соли. С точки зрения теории электролитической реакции соли - это вещества, которые в водном растворе диссоциируют с образованием катионов основания и анионов кислотного остатка.
В общем виде уравнение электролитической диссоциации солей имеет следующий вид:
|
|
|
Соль -> Катион основания + Анион кислотного остатка
Гидролиз солей.
Гидролиз – взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды.
Гидролиз солей – взаимодействие ионов соли с водой, в результате чего изменяется реакция среды, или из раствора выделяется какой-либо продукт, или происходит и то, и другое одновременно.
Соли, образованные сильным основанием и слабой кислотой частично гидролизуются и дают щелочную реакцию среды.
Соли, образованные слабым основанием и сильной кислотой, частично гидролизуются и дают сильную реакцию среды.
Соли, образованные слабым основанием и слабой кислотой, в растворе существовать не могут, так как необратимо гидролизуются.
Соли, образованные сильным основанием и сильной кислотой не могут подвергаться гидролизу, так как ионы, образующие эту соль, не могут образовывать прочные ионные связи ни с ионами H, ни с ионами OH, реакция среды остается нейтральной.
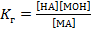 - константа гидролиза. НА – кислота, МОН – основание; МА – образованная ими соль.
- константа гидролиза. НА – кислота, МОН – основание; МА – образованная ими соль.
Значение константы гидролиза характеризует способность данной соли подвергаться гидролизу.
 2018-01-21
2018-01-21 8060
8060
