Необратимые протекают до конца, в реакционной смеси образуется осадок.
BaCl2+H2SO4→BaSO4(бел.цв.)↓+2HCl
Обратимые р-ции протекают в прямом и в обратном направлении.
CO2+H2↔CO2+H2O 3H2+N2↔2NH3
→прямая реакция ←обратная реакция
Равновесие -это условие, для которого соблюдается равенство прямой и обратной реакций.
Для реакций в общем виде: aA+bB↔cC+dD, где А и В-исходные в-ва, a и b-стехиометрические коэффициенты.
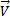 =
= 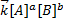
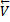 =
= 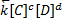
Для состояния равновесия: 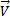 =
= 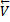 (скорости равны) преобразуем это равенство
(скорости равны) преобразуем это равенство 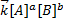 =
= 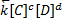
Для обратимых р-ций вводят понятие константы равновесия: 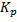 =
=  . Она зависит от t и не зависит от концентрации реагирующих в-в. Присутствие катализатора так же не влияет на его значение.
. Она зависит от t и не зависит от концентрации реагирующих в-в. Присутствие катализатора так же не влияет на его значение.
Равновесие сохраняется до тех пор, пока соблюдается равенство, как только параметры системы будут изменяться, так будет равновесие смещаться. Направление смещения равновесия определяется принципом Ле Шателье. Если на систему, находящуюся в состоянии равновесия, оказывать внешнее воздействие, то состояние равновесия смещается в направлении, которое ослабляет это воздействие. На сдвиг равновесия влияют t, концентрация и p.
Влияние t. При повышении t быстрее возрастает v эндотермического процесса, который идет с поглощением тепла.
3H2+N2↔2NH3 ∆H=-92кДж/моль
∆ 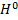 <0 ↑t равновесие смещается←
<0 ↑t равновесие смещается←
↓t равновесие смещается →
∆ 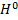 >0 ↑t равновесие смещается →
>0 ↑t равновесие смещается →
↓t равновесие смещается←
Влияние концентрации. Согласно принципу Ле Шателье, равновесие сдвигается →,если увеличить концентрации продуктов и реагентов, и ←,если увеличить концентрации продуктов.
BiCl3+H2O↔BiOCl(оксихлорид висмут)+2HCl
1)+H2O равновесие смещается → и образуется BiOCl
2)+HCl равновесие смещается ← и образуется BiCl3
Влияние давления p. Р оказывает воздействие только на газообразные в-ва. Повышение р при t=const равносильно сжатию газа. Равновесие при этом будет смещено в сторону уменьшения концентрации газообр.в-в.
↑p 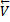 =
= 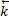 [CO2] равновесие смещается ←
[CO2] равновесие смещается ←
↓р равновесие смещается →
Увеличение р смещает равновесие в сторону уменьшения объема системы.
H2+Cl2→2HCl в данной реакции увеличение или уменьшение р на равновесие не влияет. 2 моль=2 моль.
Катализатор на смещение равновесия не влияет.
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип, известный под названием принципа Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Действительно, при введении в систему одного из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества. "При повышении давления оно смещается так, что давление в системе снижается; при повышении температуры равновесие смещается в сторону эндотермической реакции — температура в системе падает.
Принцип Ле Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растьорение, происходит в соответствии с принципом Ле Шателье.
22 билет Растворы
Растворы - гомогенные смеси переменного состава, состоящие из двух или более компонентов. Растворы делят по размеру частиц растворенного в-ва на истинный и коллоидный.
Истинные р-ры: в таких растворах растворенное в-во диспергированно до атомного или молекулярного состояния. Истинные р-ры термодинамически устойчивы и неограниченно стабильны во времени.
Коллоидные р-ры: это гетерогенные дисперсные системы, в которых частицы растворенного в-ва обладают ультрамикроскопической (коллоидной) степенью дробления. Растворы так же делят по кол-ву растворенного в-ва на разбавленный, концентрированный и насыщенный.
Насыщенный р-р -такой р-р, который находится в равновесии с избытком растворенного в-ва (скорость растворения=скорость кристаллизации).Такой р-р содержит максимально возможное для данных условий кол-во растворенного в-ва. Если скорость растворения превышает скорость кристаллизации, то р-ры образуются ненасыщенные.
Если наоборот, то пересыщенные р-ры. По соотношению кол-ва растворенного в-ва и растворителя различают растворы разбавленные и концентрированные(р-ры близкие к состоянию насыщения). Концентрация насыщенного р-ра (V, t const)при строго определенных условиях (p, t const-растворимость).
Раствор состоит из растворителя, который преобладает в растворе, и растворенного в-ва - это и есть компоненты раствора.
Растворимость -способность в-ва растворяться в растворителе. По растворимости в-ва делят на 3 группы: 1)хорошо растворимые (Р) (10г в-ва на 1л при t=20 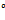 ).
).
2)малорастворимые (М) (от 0,01г до 10г на 1л воды).
3)нерастворимые (Н) (менее 0,01г на 1л).
Растворимость зависит от природы растворенного в-ва, от t и от p для газов.
Способы выражения концентрации растворов.
1)Массовая концентрация, массовая доля ω-отношение массы растворенного в-ва m[X] к массе всего р-ра m[S] ω= 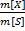 ×100% p [S]=
×100% p [S]= 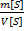 , где p -плотность р-ра S[г/
, где p -плотность р-ра S[г/ 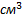 ]
]
2)Молярная концентрация, молярность 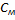 (М)-число молей растворенного в-ва
(М)-число молей растворенного в-ва 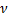 [X], содержащегося в 1л р-ра V[S],[моль/л;моль/
[X], содержащегося в 1л р-ра V[S],[моль/л;моль/ 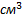 ] М=
] М= 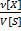 =
= 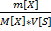
3) Эквивалентная концентрация, нормальность 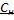 -число эквивалентов растворенного в-ва
-число эквивалентов растворенного в-ва 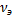 , содержащихся в 1л раствора V[S] [экв/л; моль/л; моль/
, содержащихся в 1л раствора V[S] [экв/л; моль/л; моль/ 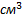 ]
] 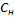 =
= 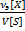 =
= 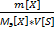
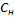 =
= 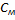 *В
*В
4) Моляльная концентрация, моляльность 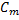 -число молей растворенного в-ва ν[X], приходящихся на 1кг растворителя
-число молей растворенного в-ва ν[X], приходящихся на 1кг растворителя 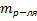 [моль/кг]
[моль/кг] 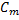 =
= 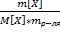
5) Титр(Т) показывает кол-во граммов растворенного в-ва m[X], содержащихся в 1мл раствора V[S] [гр/мл] Т= 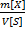 =
= 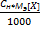 =
= 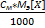
Температурный коэффициент растворимости характеризует зависимость растворимости от температуры. Чем больше этот коэффициент, тем круче возрастает растворимость соли в воде по мере повышения температуры
Зависимость между растворимостью и температурой очень удобно изображать графически — в виде кривых растворимости. Для построения кривой растворимости откладывают на горизонтальной оси температуру, а на вертикальной — растворимость вещества при соответствующей температуре
23 билет
1)Молекулы при растворении или расплавлении распадаются на ионы. Катионы(+ионы), анионы(-ионы). Процесс распада молекул электролитов на ионы наз-ся электролитической диссоциацией.
2)В растворе или расплаве ионы движутся хаотически, при пропускании через раствор или расплав катионы(+ионы) движутся к катоду(-электрод), а анионы(-ионы) к аноду(+электрод).
3)Диссоциация-процесс обратимый. Параллельно идут два процесса: диссоциация(распад) и ассоциация(объединение). NaCl↔ 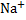 +
+ 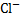
Св-во электролитов в различной степени диссоциации выражается степенью диссоциации α= 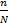 *100%
*100%
Степень диссоциации - это число, показывающее какая доля молекул распалась на ионы и равная отношению числа распавшихся молекул на ионы(n) к общему числу молекул(N).
По степени диссоциации электролиты делятся на сильные и слабые:
Сильные электролиты полностью диссоциируют на ионы.
Слабые электролиты частично диссоциируют на ионы,
α>30% 1) HCl, HBr, HI, HNO3, H2SO4, HClO4, HClO3, H2CrO4, H2Cr2O7, HMnO4.
2)щелочи
3)почти все растворимые соли; α<3%
1) HF, H2S, HCN, H3BO3, H2CO3, H2SiO3, HNO2, H3PO4, H2HPO3, HClO2, HClO.
2)нерастворимые основания +NH4OH.
3)некоторые соли: ZnCl2, HgCl2.
Степень диссоциации α зависит от природы растворителя, природы электролита, от t, от концентрации. К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например спирты, углеводы. Слабые электролиты в растворах диссоциируют не полностью, и с течением времени устанавливается динамическое равновесие между ионами и непродиссоциированными молекулами.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов — катионов и анионов
Для характеристики слабых электролитов используют константу диссоциации(константу равновесия для процесса диссоциации). Для уксусной кислоты этот процесс можно записать: CH3COOH↔ 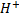 +
+ 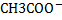
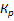 =
= 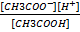
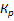 зависит: от природы диссоциирующих в-в, растворителя и t. Не зависит от концентрации. Чем выше его значение, тем легче в-во распадается на ионы, и тем сильнее электролит. Многоосновные кислоты диссоциируют ступеньчато и каждая ступень имеет свое значение константы диссоциации. На примере: 1. H2CO3↔
зависит: от природы диссоциирующих в-в, растворителя и t. Не зависит от концентрации. Чем выше его значение, тем легче в-во распадается на ионы, и тем сильнее электролит. Многоосновные кислоты диссоциируют ступеньчато и каждая ступень имеет свое значение константы диссоциации. На примере: 1. H2CO3↔ 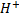 +HCO3
+HCO3 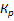 1=
1= 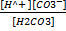 =4,5*
=4,5* 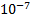 . 2.
. 2. 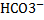 ↔
↔ 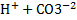
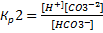 =4.7*
=4.7* 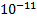
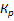 1 всегда выше
1 всегда выше 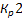 и намного выше
и намного выше 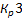 . В растворах диссоциация протекает по первой ступени.
. В растворах диссоциация протекает по первой ступени.
константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.
Константы диссоциации малорастворимых солей и гидроксидов металлов называются произведением растворимости соответствующих веществ (обозначается ПР) Оствальда закон разбавления
соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита (См. Электролиты) от концентрации раствора: 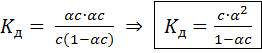
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием Действующих масс закона и равенства λ/λ∞ = α, где α — степень диссоциации. О. з. р. выведен В. Оствальдом в 1888 и им же подтвержден опытным путём. Экспериментальное установление правильности О. з. р. имело большое значение для обоснования теории электролитической диссоциации (См. Электролитическая диссоциация).
Закон Оствальда справедлив для бинарных электролитов, т.е. веществ, молекулы которых в растворе распадаются на два иона – катион и анион. В случае сильных электролитов, когда α близка к 1, знаменатель дроби стремится к нулю, а константа диссоциации Кд – к бесконечности. Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд.
24 билет
Вода очень слабый электролит, диссоциирует незначительно. H2O↔ 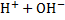
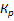 =
= 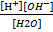 =1,8*
=1,8* 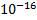 , где [H+], [OH-] –молярные концентрации частиц в воде.
, где [H+], [OH-] –молярные концентрации частиц в воде.
Ионное произведение воды: 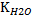 =
= 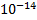 =const. [H+][OH-]=
=const. [H+][OH-]= 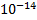 . Чтобы охарактеризовать реакцию среды любого раствора, указывают концентрацию ионов водорода (редко гидроксогрупп). В чистой воде [H+]=[OH-]=
. Чтобы охарактеризовать реакцию среды любого раствора, указывают концентрацию ионов водорода (редко гидроксогрупп). В чистой воде [H+]=[OH-]= 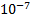 . Нейтральная среда [H+]=[OH-]=
. Нейтральная среда [H+]=[OH-]= 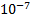 .
.
Кислая среда [H+]> 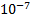 >[OH-]. Щелочная среда [H+]<
>[OH-]. Щелочная среда [H+]< 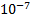 [OH-].
[OH-].
Для удобства концентрацию ионов водорода характеризуют водородным показателем pH.
pH=-lg[H+]. pH-это качественная характеристика среды. В лаборат.условиях для замеров pH используют индикаторную бумагу, pH-метры. (моль/л)
Диссоциацию воды часто записывают в более простом виде:
Н2О = Н+ + ОН‾.
Водородным показателем, или pH, называется взятый с обратным знаком десятичный логарифм концентрации водородных ионов в растворе:
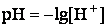
25 билет
Гидролиз -это реакция взаимодействия соли с водой, в результате которой образуется слабодиссоциированное в-во.
Различают 3 случая гидролиза:
1) гидролиз соли, образованный сильным основанием и слабой кислотой.
а) записываем ур-ие диссоциации соли. CH3COONa↔CH3COO-+Na+. Определяем ион, который подвергается гидролизу, этот ион соответствует слабому электролиту. Ацетат ион хар-ся уксусной кислотой, а уксусная кислота-слабый электролит. Именно ацетат ион взаимодействует с водой. б)записываем ур-ие гидролиза в ионном виде: CH3COO-+H+OH-↔CH3COOH+OH- pH>7.
в)записываем ур-ие гидролиза в молекулярном виде: CH3COONa+H2O↔CH3COOH+NaOH. Для многоосновных кислот гидролиз протекает ступенчато, при этом образуется кислая соль. Гидролиз протекает по первой ступени.
K2CO3↔2K++CO3-2
1)CO3-2+H+OH-↔HCO3-+OH- pH>7
K2CO3+H2O↔KHCO3+KOH
2)HCO3-+H+OH-↔H2CO3+OH-
KHCO3+H2O↔H2CO3+KOH
2) Гидролиз соли, образованной сильной кислотой и слабым основанием(гидролиз протекает по катиону). Продуктами такого гидролиза яв-ся или основная соль, или слабое основание. NH4Cl↔NH4++Cl- В ионном виде: NH4++H+OH-↔NH4OH+H+ pH<7 В молекулярном виде: NH4Cl+H2O↔NH4OH+HCl. Гидролиз многокислотных солей протекает ступенчато. В растворе происходит образование основной соли.
3) гидролиз соли, образованной слабым основанием и слабой кислотой(полный гидролиз). CH3COONH4↔CH3COO-+NH4+ В ионном виде не имеется. В молекулярном виде: CH3COONH4+H2O↔CH3COOH+NH4OH pH>=7.
4)если соль образована сильным основанием и сильной кислотой, то гидролизу не подвергается. NaCl+H2O гидролиз не идет.
Совместный гидролиз. При сливании растворов солей, кроме реакции ионного обмена, вероятно протекание взаимного гидролиза. Взаимный гидролиз протекает по схеме: 1.FeCl3. Fe3+ +HOH↔FeOH2+ +H+. Раствор содержит ионы Fe(слабый электролит Fe(OH)3), который подвергается гидролизу по 1 ступени. FeCl3+H2O↔FeOH2+Cl2- +HCl. 2. Na2CO3. Раствор имеет в своем составе карбонат ион(анионы слабой угольной кислоты), которое подвергается гидролизу по 1 ступени.
Ионный вид: CO3- +H+OH-↔HCO3- +OH-.
В молекулярном виде: Na2CO3+H2O→Na+HCO3- +NaOH.
При сливании двух солей идет нейтрализация FeOHCl2+NaHCO3↔6NaCl+Fe2(CO3)3+H2O.
Образованный в результате реакции карбоната железа подвергается полному гидролизу: Fe2(CO3)3+6H2O→2Fe(OH)3↓+3H2O+3CO2↑. Получаем суммарное ур-ие совместного гидролиза: 2FeCl3+3Na2CO3+3H2O→6NaCl+2Fe(OH)3↓+3CO2↑
водных растворах электролитов химические реакции протекают с участием ионов, такие реакции называются ионно-обменными, а уравнения этих реакций – ионными уравнениями.
26 билет
Электрохимия изучает ОВ процессы(ОВП), которые идут под действием постоянного эл.тока(электролиз)или сами яв-ся его источником. Основным предметом электрохимии яв-ся процессы, протекающие на электроде и при прохождении тока в растворах(в электролите).
Двойной эл.слой. при погружении металла(пластинки) в воду или в раствор своей соли под действием полярных молекул воды, металл посылает в раствор свои ионы по схеме:
Ме0-ne→Me(n+). Me(n+)+ne→Me0. Электроны остаются на пластинке и заряжают ее отрицательно, а ионы, перешедшие в раствор, заряжают жидкость положительно. Ионы металла удерживаются вблизи металлич.пластинки силами электростатического притяжения, возникает двойной эл.слой шириной  см с определенной разностью потенциалов. С течением времени устанавливается динамическое равновесие: Ме0↔Ме(n+)+ne.
см с определенной разностью потенциалов. С течением времени устанавливается динамическое равновесие: Ме0↔Ме(n+)+ne.
Активные металлы посылают свои ионы в раствор Zn0-2e→Zn2+. Малоактивные забирают на свою поверхность ионы из раствора Cu2++2e→Cu0.
Электродный потенциал -разность потенциалов, возникающих на границах электронных электролитов (ɛ; ϕ[B]). Он зависит от природы металла, концентрации его ионов в электролите и от t.
Если концентрация иона составляет 1моль/л при t=25  C, ϕ обозначают как Е
C, ϕ обозначают как Е  ϕ
ϕ  и наз-ся стандартным электродным потенциалом. Абсолютное значение электродного потенциала определить невозможно. Поэтому определяют разность электродных потенциалов исследуемого металла и электроды сравнения – водородного электрода. Формула Нернста ϕ= ϕ
и наз-ся стандартным электродным потенциалом. Абсолютное значение электродного потенциала определить невозможно. Поэтому определяют разность электродных потенциалов исследуемого металла и электроды сравнения – водородного электрода. Формула Нернста ϕ= ϕ  +
+ 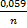 lg[
lg[ 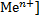
Электрохимические процессы это окислительно-восстановительные реакции, которые сопровождаются возникновением электрического тока или вызываются электрическим током.
В электрохимических процессах окислительная и восстановительная полуреакции пространственно разделены, а электроны переходят от восстановителя к окислителю не непосредственно, а по проводнику внешней цепи, создавая электрический ток. В О.В.Р этого типа наблюдается взаимное превращение химической и электрической форм энергии.
Выделяют две группы электрохимических процессов:
· процессы превращения электрической энергии в химическую (электролиз);
· процессы превращения химической энергии в электрическую (гальванические элементы).
Простейшая электрохимическая система состоит из двух электродов – проводников первого рода с электронной проводимостью, находящихся в контакте с жидким (раствор, расплав) или твердым электролитом - ионным проводником второго рода. Электроды замыкаются металлическим проводником, образующим внешнюю цепь электрохимической системы
В настоящее время за нуль принят потенциал стандартного водородного электрода. Такой электрод состоит из платинированной платины, контактирующей с газообразным водородом, находящимся под давлением 101 кПа p=1, и раствором, в котором активность ионов H+ равна единице (рис. VII.3). Водородный электрод относится к газовым электродам, т. е. электродам, в котором по крайней мере один из реагентов является газообразным
Если из всего ряда стандартных электродных потенциалов выделить только те электродные процессы, которые отвечают общему уравнению
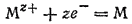
то получим ряд напряжений металлов. В этот ряд всегда помешают, кроме металлов, также водород, что позволяет видеть, какие металлы способны вытеснять водород из водных растворов кислот. в отличие от периодической системы элементов, ряд напряжений металлов не является отражением общей Закономерности, на основе которой можно давать разностороннюю Характеристику химических свойств металлов. Ряд напряжений Характеризует лишь окислительно-восстановительную способность Электрохимической системы «металл — ион металла» в строго определенных условиях: приведенные в нем величины относятся к водному раствору, температуре 25 гр и единичной концентрации (активности) ионов металла.
27 билет
Гальванический Элемент -это устройство, предназначенное для преобразования хим.энергии ОВР в электрическую. Простейшим элементом яв-ся элемент Вольта. Он хар-ся тем, что 2 электрода находятся в общем электролите. Схему ГЭ можно записать след.образом:
(-)А, Zn|H2SO4|Cu, K(+)
A(-)Zn-2e→Zn(2+)
K(+)2 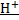 +2e→H2↑
+2e→H2↑
Zn+2H+→Zn(2+)+H2↑
Zn+H2SO4→ZnSO4+H2↑
Главное отличие Даниэля-Якоби состоит в том, что электроды опущены в растворы своих солей, поэтому при работе такого ГЭ на аноде(А) протекает ок-ие металла электрода, а на катоде(К) происходит вос-ие катионов металла электролита из катодного пространства. При работе ГЭ на каждом электроде возникает собственный электродный потенциал. Разность этих электродных потенциалов н-ся электродвижущей силой работы ГЭ (ЭДС). ЭДС= ϕ 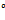 кат- ϕ
кат- ϕ 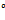 ан(для элемента Даниэля-Якоби). ϕ кат всегда больше ϕан. Эдс всегда величина положительная.
ан(для элемента Даниэля-Якоби). ϕ кат всегда больше ϕан. Эдс всегда величина положительная.
Элемент Даниэля
Работа гальванических элементов основана на пространственном разделении процессов приема и отдачи электронов. Рассмотрим один из наиболее старых гальванических элементов - элемент Даниэля. Он состоит из цинкового электрода, погруженного в раствор сернокислого цинка, и медного, погруженного в раствор сернокислой меди. Оба раствора разделены цилиндром из пористого материала. Схематически конструкцию этого элемента можно представить следующим образом;
(-)Znl ZnSCU - раствор | CuSO4 - раствор! Си(+)
Действие элемента Даниэля основано на том, что с поверхности цинка в раствор переходят ионы цинка Zn2+; при этом по проводнику, соединяющему цинк и медь, электроны от цинка перетекают к меди, где они взаимодействуют с ионами меди (Си2+), находящимися в соприкосновении с поверхностью меди, и нейтрализуют их. Цинк представляет собой отрицательный электрод элемента, медь - положительный. Элемент Даниэля представляет собой прибор, который непосредственно (минуя фазу тепла), теоретически полностью, превращает освобождающуюся химическую энергию в электрическую в соответствии с реакцией
ЭДС всякого работающего элемента является величиной существенно положительной. ЭДС гальванического элемента, т.е. наибольшая разность потенциалов между электродами его равна алгебраической сумме отдельных разностей (скачков) потенциала, существующих на поверхностях раздела между различными фазами, образующими данный элемент.
Итак, при работе элемента Якоби-Даниэля протекают следующие процессы:
1) реакция окисления цинка: Zn - 2е ® Zn2+.
Процессы окисления в электрохимии получили название анодных процессов, а электроды, на которых идут
процессы окисления, называют анодами;
2) реакция восстановления ионов меди: Сu2+ + 2е «Сu.
Элемент Вольта
Он состоит из медной (Сu) и цинковой (Zn) пластинок, опущенных в раствор серной кислоты (H2SO4). Вследствие химической реакции, происходящей между цинком и серной кислотой, на цинке образуется излишек электронов. Цинк заряжается отрицательно и является отрицательным полюсом. Раствор и медная пластинка, в него погруженная, заряжаются положительно. В результате возбуждается ЭДС, равная примерно одному вольту, которая сохраняется все время, пока цепь не замкнута.
28 билет
Для питания радиоэлектронных устройств на транзисторах необходимо постоянное напряжение. Если радиоэлектронное устройство потребляет маленькую мощность, то такое устройство достаточно часто питают от химического источника тока. Химические источники тока подразделяются на первичные и вторичные. К первичным источникам тока относятся различные гальванические элементы и батареи, составленные из них. Вторичные источники тока - это аккумуляторы.
Наиболее распространенный гальванический элемент — это элемент Лекланше. Из таких элементов, например, составлена батарейка карманного фонаря. Элементы Лекланше применяются также в технике связи.
Элемент Лекланше состоит из угольного стержня, окруженного мешочком с деполяризатором, цинкового цилиндра и раствора электролита. Угольный стержень служит положительным электродом. Деполяризатор состоит из перекиси марганца и графита. Перекись марганца окисляет водород, который во время работы элемента выделяется на положительном электроде. Графит добавляется для лучшей проводимости. Электролитом служит насыщенный раствор нашатыря (хлористого аммония). В элементы для карманных фонарей он заливается не жидкий, а в смеси с крахмалом и мукой. Поэтому он становится похож на студень и не выливается. При работе элемента Лекланше угольный стержень не портится. Деполяризатор может служить очень долго. А вот цинк разъедается, и раствор истощается и засоряется посторонними веществами. Поэтому для восстановления элемента необходимо сменить раствор и восстановить цинковый электрод.
Элемент Лекланше дает напряжение около 1,5 в. Для получения более высоких напряжений соединяют несколько элементов в батарею. Так, в батарейке карманного фонаря три последовательно соединенных элемента Лекланше дают напряжение 4,35 в.
Кислотные аккумуляторы -о суммарной энергетической ёмкости кислотно-свинцовые аккумуляторы занимают первое место. Разработано и используется большое количество вариантов аккумуляторов различающихся как по конструкции, так и по назначению. Разновидностями кислотных аккумуляторов являются достаточно известные гелиевые аккумуляторы, а также аккумуляторы с абсорбированным электролитом, изготовленные по технологии AGM. Основные преимущества кислотных батарей, это невысокая стоимость, большой срок службы, допускают большой разрядный ток, небольшой ток саморазряда. К общим недостаткам можно отнести небольшую энергоёмкость на каждый килограмм веса, длительное время заряда, большая зависимость характеристик от температуры, не допускают длительного хранения в разряженном состоянии.
Топливный элемент – это устройство, которое эффективно вырабатывает постоянный ток и тепло из богатого водородом топлива путем электрохимической реакции.
Топливный элемент подобен батарее в том, что он вырабатывает постоянный ток путем химической реакции. Опять же, подобно батарее, топливный элемент включает анод, катод и электролит. Однако, в отличие от батарей, топливные элементы не могут накапливать электрическую энергию, не разряжаются и не требуют электричества для повторной зарядки. Топливные элементы могут постоянно вырабатывать электроэнергию, пока они имеют запас топлива и воздуха. Правильный термин для описания работающего топливного элемента – это система элементов, так как для полноценной работы требуется наличие некоторых вспомогательных систем. Топливные элементы вырабатывают электроэнергию и тепло вследствие происходящей электрохимической реакции, используя электролит, катод и анод.
29 билет
Электролиз – это совокупность ОВ процессов, протекающих на электродах в растворах и расплавов электролитов под действием постоянного эл.тока. Процессы окисления протекают на положительно заряженном аноде, процессы восстановления на катоде.
Анодные процессы (отдача)
Катодные процессы (присоединение)
Характер процессов при электролизе опр-ся природой электролитов и значениями электродных потенциалов.
Процессы на катоде:
1) Восстановление катионов до свободных атомов или молекул.
2) Восстановление катионов до более низких степеней окисления.
3) Восстановление молекул воды до свободного Н₂
Правила:
1) В первую очередь восстанавливаются частицы имеющие максимальное значение ϕ°.
а) Кt, стоящие в электро-химическом ряду напряжений до алюминия не могут быть восстановлены из водных растворов.
б) в концентрированных растворах ионы металлы расположены в коэффициент химической реакции между алюминием и водородом восстановления.
в) Катионы металла с ϕ>0 восстановлены до свободных.
г) Если раствор содержит несколько ионов металла, то восстановление их происходит в порядке уменьшить ϕ°.
Процессы на аноде:
1) Растворение металлов, из которого сделан анод.
2) Окисление анионов.
3) Повышение степени окисления ионов.
4) Окисление ионов воды.
Правила:
1) Окисляются частицы с меньшим значением.
2) Кислотные остатки (кислородосодержащие) не окисляются - вместо них окисляется вода.
3) В водных растворах не окисляются ионы F⁻ до свободных
4) В случае растворимых анодов происходит процесс растворения металлов (рафинирование)
электролиз растворов солей с растворимым анодом сводится к окислению материала анода (его растворению) и сопровождается переносом металла с анода на катод. Это свойство широко используется при рафинировании (очистке) металлов от загрязнений.
30 билет
1 закон Фарадея:
Масса вещества, окисленного на аноде или восстановленного на катоде при электролизе пропорционально количеству электричеству, происходящего через электролиз.
m = K*Q, где М – количество выделенного вещества,
K – электрохимический эквивалент,
Q – количество электричества.
K = 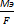 ; F = 95459 Кл (число фарадея)
; F = 95459 Кл (число фарадея)
Q = Y* 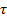 , где τ – время, Y – сила тока.
, где τ – время, Y – сила тока.
2 закон Фарадея:
Равное количество электричества окисляет или восстанавливает из различных растворов эквивалентное количество вещества.
m = 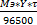 для газов ν =
для газов ν = 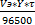
Электролиз находит широкое применение в технике.
Очистка или рафинирование металлов. Процесс происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластинка из чистого металла, а электролитом — раствор соли данного металла, например, при рафинировании меди — раствор медного купороса. В загрязненных металлах могут содержаться ценные примеси. Так, в меди часто содержится никель и серебро. Для того чтобы на катоде выделялся только чистый металл, необходимо учитывать, что выделение каждого вещества начинается лишь при некоторой определенной разности потенциалов между электродами, называемой "потенциалом разложения". При надлежащем ее выборе из раствора медного купороса на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
Электрометаллургия. Некоторые металлы, например, алюминий, получают методом электролиза из расплавленной руды. Электролитической ванной и одновременно катодом служит железный ящик с угольным полом, а анодом — угольные стержни. Температура руды (около 900°С) поддерживается протекающим в ней током. Расплавленный алюминий опускается на дно ящика, откуда его через особое отверстие выпускают в формы для отливки.
Гальваностегия — электролитический способ покрытия металлических изделий слоем благородного или другого металла (золота, платины), не поддающегося окислению. Например, при никелировании предмета он сам служит катодом, кусок никеля — анодом. Пропуская через электролитическую ванну в течение некоторого времени электрический ток, покрывают предмет слоем никеля нужной толщины.
Гальванопластика, или электролитическое осаждение металла на поверхности предмета для воспроизведения его формы, была изобретена в 1837 г. русским ученым Б. С. Якоби, предложившим использовать электролиз для получения металлических отпечатков рельефных предметов (медалей, монет и др.). С предмета снимают слепок из воска или вырезают выпуклое изображение на деревянной доске и делают его проводящим, покрывая слоем графита. Затем опускают слепок или доску в качестве катода в электролит. Анодом служит кусок металла, используемого для осаждения. Этим способом изготовляют, например, типографские клише.
31 билет Коррозия металлов
Коррозия -это разрушение металла под действием агрессивной среды. Коррозия-это ОВ гетерогенный процесс, протекающий на границе раздела фаз металл/жидкость или металл/газ. Это самопроизвольный процесс,приводящий к образованию термодинамических, более устойчивых в-в.
Химическая коррозия осуществляется путем непосредственного переноса электронов от атомов металла к ок-лю.
Электрохимическая коррозия -это коррозия, протекающая среди электролитов. В отличии от хим.коррозии передача электронов протекает через токопроводящую среду в воду, насыщенную кислородом или слаб.кислоту. Коррозия возникает в местах контактов 2х металлов и их примесей, имеющих разнородные электродные потенциалы. В системе обр-ся микрогальваническая пора. Атмосферная коррозия протекает во влажном воздухе при обычной t, поверхность Ме покрывается пленкой влаги, содержащей растворенный кислород. Интенсивность возрастает с увеличением влажности, содержания газообр.примесей, пыли, копоти, а также при наличии на поверхности Ме шероховатости и трещин. Различают сухую и влажную. Сухая протекает при влажности до 6%. Влажная при выше 60%.
Основные способы борьбы с коррозией. Изоляция металлов от агрессивной среды(покрытие). Металлич.покрытия-это покрытия защищаемого Ме слоем другого Ме, практически не корродируемого в тех же условиях, различают покрытия слоем активного Ме(анодное покрытие) и слоем менее актив.Ме(катодное покрытие). При нарушении покрытий возникает ГЭ, который может как замедлить коррозию, так и ускорить ее.
При электрохимической коррозии металл или сплав, взаимодействуя с электролитом, переходит в раствор в виде положительно заряженных частиц (ионов).
Происходящие здесь процессы напоминают действие простейшего гальванического элемента.
Если такой элемент состоит из пластинки цинка, опущенной в раствор сернокислого цинка, и пластинки меди, опущенной в раствор сернокислой меди, то при замыкании этих пластинок возникает электрический ток и электроны начинают перемещаться от цинковой пластинки к медной.
Это значит, что у цинка большая способность превращаться в положительно заряженные частицы (ионы).
В силу этих причин цинковая пластинка в гальваническом элементе в процессе работы будет разрушаться. Образование микрогальванических элементов вследствие неоднородности структуры при взаимодействии металлов и сплавов с жидкостями-электролитами и составляет сущность процесса электрохимической коррозии.
32 билет
Защита от коррозии
Способы защиты металлов от коррозионных процессов базируются на ряде методов:
• применение электрохимической защиты, которая позволяет снизить степень коррозионных процессов благодаря законам гальваники;
• уменьшение агрессивной реакции производственной среды;
• повышение химического сопротивления металлических материалов;
• изолирование поверхности металлических конструкций от негативного атмосферного воздействия.
 2018-01-21
2018-01-21 935
935







