Ядерный синтез.
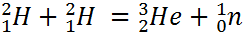 ;
;
4) Периодический закон и Периодическая система элементов Д.И. Менделеева.
Периодический закон – свойство химических элементов, а так же образуемых ими соединений находятся в периодической зависимости от массы атома.
Современная формулировка - …в зависимости от заряда ядра атома.
Графическим отображением периодического закона является периодическая система элементов. Периодическая система состоит из 7 периодов и 18 вертикальных столбцов(групп). Элементы, попавшие в одну группу обладают сходными химическими свойствами. Ряд групп имеют трювиальное название. В периодах расположены элементы, в которых происходят заполнения одного энергетического уровня.
5) Характер изменения характеристик атомов химических элементов в Периодической системе.
В периодах расположены элементы, в которых происходит заполнение одного энергетического уровня.
1. радиус атома – по группе сверху вниз увеличивается
2. Энергия ионизации атома (I) – энергия необходимая для отрыва электрона на бесконечно большое расстояние. По группе сверху вниз уменьшается, по периоду слева направо – измен-ся немонотонно (периодичность)
3. сродство к электрону (противоположность I) (E). По группе сверху вниз уменьшается, по периоду слева направо – измен-ся немонотонно.
4. ЭО ( ) хар-ет способность атома притягивать к себе е хим связи. По группе сверху вниз уменьшается, по периоду слева направо увеличивается.
) хар-ет способность атома притягивать к себе е хим связи. По группе сверху вниз уменьшается, по периоду слева направо увеличивается.
5. валентность. В группе одна. По периоду слева направо высшая увеличивается.
6. Степень металличности- неметалличтонсти. по группе ↓ Ме усидивается, неМе – ослабевают. По периоду → Ме ослабевают, неМе усиливаются
6) Строение атома. Квантовые числа.
Атом – это мельчайшая неделимая химическая частица вещества. Характеристикой атома является масса. Ar – относительная атомная масса. 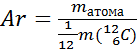 . Атом= электроны + ядро(протоны и нейтроны). р=е=Z – порядковый номер; р+п=А – массовое число
. Атом= электроны + ядро(протоны и нейтроны). р=е=Z – порядковый номер; р+п=А – массовое число
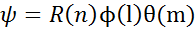 R-радиальная часть,
R-радиальная часть, 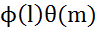 - угловая
- угловая
n, l, m –квантовые числа, от которых зависит распределение электронов в атоме. Волновая функция 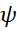 с определенном набором 3 квантовых чисел наз-ся электронной орбиталью. Эти 3 квантовых числа полностью опроеделяют расположение электронов в атоме.
с определенном набором 3 квантовых чисел наз-ся электронной орбиталью. Эти 3 квантовых числа полностью опроеделяют расположение электронов в атоме.
n – главное. n=[1, ∞). От n зависит: r(расстояние электрона от ядра). ↑n - r↑; E(энергия электрона атома)) Е↑ - n↑ 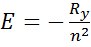 ,
, 
l -орбитальное (побочное) l = 0 до n-1. Каждому значению L соответствует орбиталь особой формы. Орбитали с L = 0 называются s-орбиталями, L = 1 – р-орбиталями, L = 2 – d-орбиталями, L = 3 – f-орбиталями
m - магнитное m= +l до -l. Численно значение m определяет ориентацию орбиталей относительно осей координат.
s -спиновое может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона:  и
и  .
.
7) Строение многоэлектронных атомов. Правило Клечковского, Хунда. Принцип Паули.
Первое правило Клечковского. Под уровни заполняются электронами в порядке увеличения суммы главного и орбитального квантовых чисел.
Второе правило Клечковского. В случае равенства l+n, первым будет заполняться подуровень с меньшим n.
Правило Хунда. Электроны заполняют подуровень таким образом, чтобы суммарный спин был максимальным.
Принцип Паули. В атоме не могут находится два электрона с одинаковым набором всех четырех квантовых чисел.
8) Общие представления о химической связи. Основные типы химической связи.
Химическая связь возникает за счет уменьшения энергии взаимодействующих атомов, по сравнению с суммарной энергией ионизированных атомов. При образовании хим связи при атомах энергия всегда выделяется. Силы вызывающие хим связь имеют электрическую природу.
Ковалентной – называется связь, которая образована за счет формирования общей электронной пары двумя атомами. Первый механизм образования – обменный, а второй донорно-акцепторный.(полярная – разные неМе, неполярная – одинаковы Ме)
Ионная — очень прочная химическая связь, образующаяся между положительно заряженным ионом (катионом) и анионом, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Для ионной связи вместо энергии связи применяется термин «энергии кристаллической решетки».
Металлическая — это одновременное существование положительно заряженных атомов и свободного электронного газа.(между Ме)
(Водородная связь —осущ-ся между положительно заряженным атомом водорода и отрицательно заряженным атомом неМе с высокой ЭО)-сила межмалек. взаимод-я.
9) Ковалентная связь и ее основные характеристики.
Ковалентной – называется связь, которая образована за счет формирования общей электронной пары двумя атомами. Первый механизм образования – обменный, а второй донорно-акцепторный.
Валентность опред-ся числом неспареных электронов в атоме – спин-валентность. В – это число образуемых атомом ковалентных связей – ковалентность.
Длина связи – расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь. С увеличением кратности длина связи уменьшается. С увеличением радиуса связь увеличивается.
Энергия связи – энергия, необходимая для гомологического распада связи и удаление атомов на бесконечно большое расстояние. С увелич-ем кратности – Е ↑. Чем больше длина, тем меньше энергия.
Полярность - Дипольный момент связи (μ) – векторная величина, характеризующая полярность связи (измеряется в дебаях D или кулон-метрах: 1 D = 3,33·10-30 Кл·м). μ может изменятся от 0(ковалентно-неполярная) до 7 Д.
СО2(молекула неполярная) и SО2(молекула полярная) – связь полярная. Н2 – неполярная связь.
Разница в Эо между атомами: ∆ЭО<2 – ковалентная, ∆ЭО≥2 - ионная
10) Ионная и металлическая связь. Особенности физических свойств соединений с этими типами химической связи.
Ионная — очень прочная химическая связь, образующаяся между положительно заряженным ионом (катионом) и анионом, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью. Для ионной связи вместо энергии связи применяется термин «энергии кристаллической решетки».
Металлическая — это одновременное существование положительно заряженных атомов и свободного электронного газа.
Физические свойства веществ с ионным типом связи(пр соль): Тплав высокая, твердость средне-высокая, прочность средне-низкая, диэлектрик, теплопроводность низкая, летучести(запах) нет, растворим(в воде)
Физические свойства веществ с металлическим типом связи(пр Ме любой): высокая температура плавления, твердось высокая, прочность высокая, обладают высокой электропроводимостью, обладают высокой теплопроводностью, не имеют запаха/нет летучести, растворяются друг в друге.
11) Водородная связь и ее влияние на физические свойства соединений.
Водородная связь —осущ-ся между положительно заряженным атомом водорода и отрицательно заряженным атомом неМе с высокой ЭО
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур плавления и кипения, теплоты парообразования и плавления. Например, вода, фтороводород и аммиак имеют аномально высокие температуры кипения и плавления. Под влиянием водородных связей изменяются и химические свойства.
12) Межмолекулярное взаимодействие, его природа и типы.
Межмолекулярное взаимодействие: силы Ван-дер-Ваальса= дисперсионные+ориентационные+индукционные; водородная связь.
Дисперсионное взаимодействие — яв-ся самым универсальным взаимодействием. Дисперсионные силы проявляются между любыми типами молекул как полярных, так и неполярных, хотя в случае полярных(Не, Н2, О2, СО2, СН4) дисперсионное взаимодействие яв-ся единственно возможным. Т.о. движущие силы возникновения этого взаим-я яв-ся электростатическое притяжение мгновенно возникающих диполей. 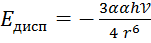
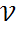 -частота колеб-й электронов,
-частота колеб-й электронов,  - пляризуемость молекулы (физ величина),
- пляризуемость молекулы (физ величина), 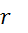 - среднее межмолекулярное расстояние,
- среднее межмолекулярное расстояние, 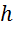 - постоянная Планка
- постоянная Планка
Ориентационное взаимодействие – осуществляется только между полярными молекулами, то есть у тех, у кого дипольный момент постоянный, например: HCl, SO2,PH3. 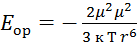 к=
к= 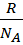 – постоянная Гольцмана, Т – постоянная темпер-ра,
– постоянная Гольцмана, Т – постоянная темпер-ра, 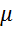 - постоянный дипольный момент.
- постоянный дипольный момент.
Индукционное взаимодействие – в основном проявляется между полярными и неполярными молекулами. 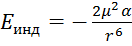
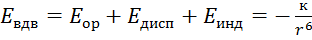 ; Проявляются силы Ван-де-Ваальса только в конденсированном состоянии (в жид-тях и тверд в-вах).
; Проявляются силы Ван-де-Ваальса только в конденсированном состоянии (в жид-тях и тверд в-вах).
Кроме сил притяжения между молекулами проявляются силы отталкивания  Водородная связь —осущ-ся между положительно заряженным атомом водорода и отрицательно заряженным атомом неМе с высокой ЭО
Водородная связь —осущ-ся между положительно заряженным атомом водорода и отрицательно заряженным атомом неМе с высокой ЭО
13) Кристаллохимия. Основные типы кристаллических решеток. Структурные типы соединений Ax, By, Cz.
Кристаллохимия — наука о кристаллических структурах и их связи с природой вещества.
Кристаллы – это твердые в-ва, состоящие из повторяющихся группировок атомов. В кристаллах в отличие от жидкостей или газов реализуется как ближний так и дальний порядок(в жид – только ближний, в газах – нет). В зав-ти от того какие типы частиц образуют кристаллическую решетку, кристаллы делятся на:
· Молекулярные кристаллы (состоят из отдельных молекул) – йод+нофталин+инсулин.
· Атомные кристаллы (образованы отдельными атомами, которые связаны между собой ковалентными связями) – алмаз, кварц.
· Ионные кристаллы (образованы отдельными, простыми или сложными, ионами, связь ионная) – NaCl+ сульфат аммония.
· Металлические кристаллы (образованы атомами и связаны металлической связью).
Основные типы кристаллических решеток.
Кубический: a=b=c, α=β=γ=90градусов.
Тетрагональная: a=b≠c, α=β=γ=90градусов.
Ромбическая: a≠b≠c, с>aи b, α=β=γ=90градусов.
Моноклинная: a≠b≠c, α≠90, β=γ=90градусов.
Триклинная: a≠b≠c, α≠β≠γ≠90градусов.
Гексагональная: a=b≠c,α=β=90, γ=120 градусов.
Ромбоэдрическая: a=b=c,α=β=γ≠90градусов.
Структурный тип пировскита CaTiO3 тип шпинели MgAl2O4
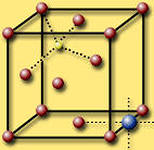
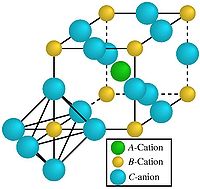 Структура перовскита. Кубич, гранецентрир из
Структура перовскита. Кубич, гранецентрир из
A — атом кальция(1 в центре) О2, атомы Al(низ) заним-т
B — атом титана 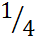 октоэдрич пустот, а
октоэдрич пустот, а
C — атом кислорода Mg(мален) 
14) Структурные типы соединений Ax, By.
Структурный тип NaCl – это две примитивные кристаллические решетки Na и Cl вдавленные друг в друга. В результате каждый из ионов окружен 6 противоионами, поэтому координационное число каждого из ионов равно 6 (Очень распространенный тип). Структурный тип CsCl – представляет примитивную решетку из ионов цезия, а в центре ионы хлора. Координационное число каждого из ионов 8. Структурный тип ZnS - представляет собой кубическую гранецентрированную решетку из атомов цинка, а атомы серы в шахматном порядке заполняют половину центроэндрических пустот. Структурный тип CaF2 – полностью заполнены центроэндрические пустоты. Кубическая гранецентрированная решетка из ионов кальция, а ионы калия заполняют все возможные центроэндрические пустоты. Координационное число 4. Структурный тип TiO2. Тетрагональная решетка. Координационное число титана 6, а кислорода 4. Такой тип встречается у многих оксидов. Структурный тип SiO2. Кубическая гранецентрированная решетка, атомы кремния заполняют половину тетраэдрических пустот, а между атомами кремния находятся атомы кислорода. Структурный тип характерен для алмаза и чистого кремния. Структурный тип ReO3. Представляет собой примитивную кубическую решетку из атомов Re, а в центрах каждого ребра находится атом кислорода. Координационное число каждого атома Re = 6, кислорода 2. Структурный тип MgAl2O3. Кубическая гранецентрированная решетка из атомов кислорода, атомы алюминия занимают ¼ актоэндрических пустот, а атомы магния 1/8 тетраэдрических пустот.
15) Способы выражения состава раствора.
Раствором называется однородная устойчивая во времени система состоящая из 2х или более в-в. Р-ры могут быть во всех 3 агригатных состояниях.
Массовая доля – отношение массы растворенного вещества к массе раствора ω(в-ва) = m(в-ва)/m(р-ра).
Объемная доля – отношение объема газа к объему всей смеси газов φ(газа) = V(газа)/V(смеси).
Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра)).
Молярная концентрация (млярный 2М)– отношение количества растворенного вещества к объему раствора С(в-ва) = n(в-ва)/V(р-ра) (моль/л).
Молярная концентрация эквивалента (нормальный 2н)
С(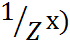 =n(
=n(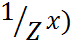 /V(р-ра) (моль-экв/л)
/V(р-ра) (моль-экв/л)
С(х)= С(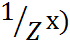 /
/ 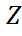
16) Растворимость. Факторы, влияющие на растворимость различных соединений. Механизм образования растворов.
Раствором называется однородная устойчивая во времени система состоящая из 2х или более в-в. Р-ры могут быть во всех 3 агригатных состояниях.
По степени дробления: истинные (отдельные молекулы или ионы) и коллоидные (частицы от  до
до 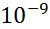 м)
м)
По насыщению: насыщенные (р-р который нах-ся в равновесии с фазой растовряемого), ненасыщенные и пересыщенные (содержание растворенного в-ва больше чем в насыщенном).
Растворимость – способность вещества растворяться в том или ином растворителе.
Факторы, влияющие на растворимость:
1) Природа растворителя и природа растворимого вещества (подобное растворяется в подобном).
2) Температура. 1) Растворенное вещество газ и для газов с увеличением температуры растворимость уменьшается, а при температуре кипения равна 0. 2) Если рассматривать жидкие и твердые вещества, то с увеличением температуры растворимость увеличивается.
3) Давление. 1) Для газов с увеличением давления растворимость увеличивается. 2) Жидкости и Твердые вещества. Если давление не высокое, то давление не влияет на растворимость. При очень высоких давлениях 20 – 100 тыс. атмосфер происходит растворение.
4) Химическая реакция
17) Ионное произведение воды. pH. Расчет pH для растворов сильных и слабых электролитов.
Ионное произведение воды - произведение концентраций ионовводорода Н+ и ионов гидроксила OH− в воде или в водных растворах. Вода – слабый электролит
Кислотность одна из важных хар-к водных р-ров – рН. По определению рН – это отрицательный десятичный логарифм из активности ионов водорода. Активность – это величина пропорциональная концентрации, поэтому
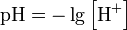 .
.
Сильные электролиты – все кислоты и основания, константы, ионизации которых больше 10–2.
Слабые электролиты – кислоты и основания, константы, ионизации которых меньше 10–4.
Неэлектролиты – не проводят эл ток. К ним относится больш-во органический соединений(СН4, С6Н6, СН3ОН), простые в-ва неМе(О2, Н2).
Электролиты – проводят ток. Кислоты(Н2SО4), щелочи (КОН, Ва(ОН)2), бол-во солей (КСl, Na3PO4).
18) Буферные растворы и расчеты их pH.
Буферные растворы — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании.
Значение pH буферного раствора можно рассчитать по формуле: 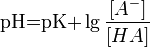 , где pK это отрицательный десятичныйлогарифм от константы диссоциации кислоты HA.
, где pK это отрицательный десятичныйлогарифм от константы диссоциации кислоты HA.
По сути 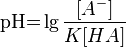 .
.
19) Гидролиз. Различные варианты гидролиза. Факторы, влияющие на степень гидролиза.
Гидролиз — это обменная (не ОВР) реакция взаимодействия сложного в-ва с водой.
Критейри протеканя реакции в водном р-ре:
Необходимо чтобы существовало сокращенное ионное уравнение, в котором молекул-ая или недиссациированная форма соединений находилась в продуктах реакции. Если только в продуктах, то реакция яв-ся практически необратимой. Если и в исходной и в продуктах – обратимая (протекает как в прямую так и в обратную сторону).
По отношению к гидролизу - 5 групп веществ:
1. Соли, образов. сильной кислотой и сильным основанием – гидролизу не подвергаются.
2. Слабой кислотой и сильным основанием – гидролиз по аниону Na3PO4 +H2O = Na2HPO4 + NaOH рН-щелочн
3. Сильной кислотой и слабым основанием – по катиону AlCl3 + H2O = AlOHCl2 + HCl рН –ксилая среда
4. Слабые основания и слабые кислоты (прочерк в менделееве) –гидролиз не идет или совместный
5. Образована ковалентн бинарными соединениями неМе млм Ме с неМе – гидролиз необратим
Факторы, влияющие на степень гидролиза: температура(при нагрев-и ↑), концентрация продуктов гидролиза(при увелич-и ↓), разбавление, добавки посторонних веществ(если тсольк 2 группе то то прибавл-е кислоты усилит гидролиз, а щелочи ослабит, для 3 – наоборот).
20) Электролитические диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. К слабым электролитам относится большинство органических кислот и многие органические основания в водных и неводных растворах.
Сильные электролиты — химические соединения, молекулы которых в разбавленных растворах практически полностью диссоциированны на ионы. Степень диссоциации таких электролитов близка к 1. К сильным электролитам относятся многие неорганические соли, некоторые неорганические кислоты и основания в водных растворах, а также в растворителях, обладающих высокой диссоциирующей способностью (спирты, амиды и др.).
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора: 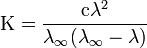 . Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.
. Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении.

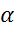 - степень диссоциации
- степень диссоциации
21) Дисперсные системы. Классификация дисперсных систем. Особые свойства дисперсных систем.
Дисперсная система — это система, образованная из двух или более фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически.
Классификация дисперсных систем:
Глубокодисперсныесистемы (размеры частиц > 100 нм).
Коллоидные системы (размеры частиц 1-10 нм).
Истинные растворы (размеры частиц < 1 нм).
По степени измельчения системы делятся на следующие классы: грубодисперсные 10-6 - 10-7 м; среднедисперсные 10-7 - 10-8 м; мелкодисперсные 10-8 - 10-9м. Дисперсная среда (прерывистая - батон), дисперсная фаза (не прерывистая – изюм).
Особые свойства дисперсных систем:
Термодинамическая неустойчивость(с ТВ средой устойчив).
Эффект Тиндаля. Существование света рассеяния.
Существование броуновского движения(более крупные не подвер)
Аномально низкие значения коэффициента диффузии(для колоид)
| Среда фаза | Г | Ж | ТВ |
| Г | - | пена | Твердая пена (монтажная) |
| Ж | Аэрозоль(туман) | эмульсия | Твердая эмульсия (жемчуг) |
| ТВ | дым | Суспензия(крупные) Золь (мелкие) Гель (мелкие, но лиофильные – способность к межмалек взаимд-ю с жидкостями) | Твердая золь (сплавы Ме) |
22) Коллоидные растворы. Особые свойства коллоидных растворов.
Коллоидное наз-ся такое состояние в-ва, при котором один из его геометрических пар-ров не превышает 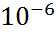 м. Если такой пар-р 1, то система наз-ся пленка( капля бензина на воде). Если 2 – волокнами или нитями (паутина, капрон). Если все 3 – свободно дисперсная система.
м. Если такой пар-р 1, то система наз-ся пленка( капля бензина на воде). Если 2 – волокнами или нитями (паутина, капрон). Если все 3 – свободно дисперсная система.
Особые свойства коллоидных систем:
· Термодинамическая неустойчивость.
· Эффект Тиндаля. Существование света рассеяния.
· Существование броуновского движения.
· Аномально низкие значения коэффициента диффузии.
Получение коллоидных систем:
1 группа – основана на измельчении более крупных частиц
2 группа – основана на укрупнении частиц – конденсационные методы:
1) Метод замены растворителя (краски)
2) Конденсация из пара (облака)
3) За счет протекания хим реакции
23) Агрегационная устойчивость коллоидных растворов.
Агрегативная устойчивость — способность системы сохранять свою степень дисперсности. Устойчивость коллоидных растворов связана с наличием одноименного заряда у коллоидных частиц. Двигаясь, частицы сближаются, при этом проявляются действие отталкивания одноименных ядер частиц и действие притяжения за счет межмолекулярных сил. В зависимости от того, какие силы преобладают, система либо устойчива, либо частицы дисперсной фазы слипаются и укрупняются.
Устойчивость коллоидных растворов можно повысить введением стабилизаторов. В качестве стабилизаторов используют высокомолекулярные соединения, такие, как белки, поверхностно-активные вещества и т.д.
Агрегативная устойчивость понижается с уменьшением электрокинетического потенциала.
24) Поверхностное натяжение. Краевой угол смачивания.
Поверхностное натяжение(  ) – это сила, действующая по нормали поверхности и стремящаяся сократить межфазную поверхность. Поверхностное натяжение – это работа по созданию единой площади новой поверхности.(Дж/
) – это сила, действующая по нормали поверхности и стремящаяся сократить межфазную поверхность. Поверхностное натяжение – это работа по созданию единой площади новой поверхности.(Дж/  или Н/м). С увеличением темп-ры
или Н/м). С увеличением темп-ры 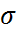 уменьшается.
уменьшается.
 С1<С2 – поверхностно активные в-ва (ПАВ)
С1<С2 – поверхностно активные в-ва (ПАВ)
С1>С2 – поверхн интенсивные в-ва (ПИВ)
Краевой угол смачивания 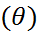 - это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз. Измеряется методом лежащей капли.
- это угол, образованный касательными плоскостями к межфазным поверхностям, ограничивающим смачивающую жидкость, а вершина угла лежит на линии раздела трёх фаз. Измеряется методом лежащей капли. 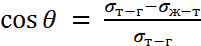
Условия:
· Поверхность идеально гладкая
· Темпер-ра постоянная
· Жид-ть чистая и ее состав не измен-ся со временем
· Жид-ть не испаряется
Если капля нах-ся в равновесии, то векторная сумма всех сил равно 0.
25) Устойчивость коллоидных растворов. Коллоидные растворы в природы.
Устойчивость коллоидных растворов — свойство коллоидной системы противостоять тенденции к агрегации (процесс объединения элементов в одну систему) частиц.
К коллоидным растворам относятся все внутренние среды организма (кровь, лимфа, внутри- и внеклеточная жидкости).
Вся природа - организмы животных и растений, гидросфера и атмосфера, земная кора и недра - представляет собой сложную совокупность множества разнообразных и разнотипных коллоидных систем.
Коллоидные растворы широко распространены в природе. Кровь, лимфа, внутриклеточные жидкости в организме являются коллоидными растворами белков и других веществ.
26) Адсорбция. Типы адсорбентов.
Адсорбция – это увеличение концентрации вещества на межфазной поверхности по сравнению с концентрацией в объеме. Адсорбция бывает:
· На границе жидкостей и газов.
· На границе жидкостей и твердых тел.
· На границе газов и твердых тел.
Физическая адсорбция осуществляется за счет сил межмолекулярного взаимодействия (сил Ван-дер-Ваальса), это взаимодействие слабое, поэтому адсорбированные частицы при нагревании могут десорбироваться.
Химическая адсорбция осуществляется за счет образования новых химических связей, поэтому она прочная, как правило, необратимая.
27) Мономолекулярная адсорбция. Изотерма мономолекулярной адсорбции Ленгмюра.
Теория мономолекулярной адсорбции основывается на следующих положениях:
· Адсорбция физическая
· Адсорбция стехиометрическая, т.е. ее можно описать при помощи ур-я: 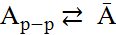 (Ā-адсорбент(тверд))
(Ā-адсорбент(тверд))
· Адсорбция осуществляется на активных центрах
· Образуется только один адсорбционный слой
· Взаимодействие между молекулами в одном слое отсутствует
К= 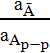 – константа равновесия (а – активность компонента(числ –тверд, знам – жидк)
– константа равновесия (а – активность компонента(числ –тверд, знам – жидк)
D= 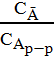 – коэф распределения [дм^3/г](С – конц-ция)
– коэф распределения [дм^3/г](С – конц-ция)
 2018-01-21
2018-01-21 900
900







