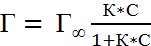 (для р-ров, для газво вместо С – Р(давление))
(для р-ров, для газво вместо С – Р(давление))
Г- адсорбция в-ва 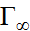 -максимальная адс-я К –константа распред-я С – равновесная конц-ция сорбцир в-ва в р-ре
-максимальная адс-я К –константа распред-я С – равновесная конц-ция сорбцир в-ва в р-ре
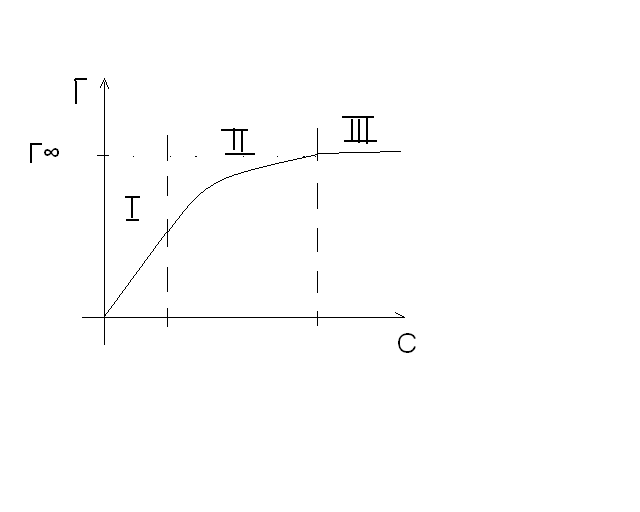 I:
I: 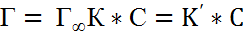 (ур-е Генри)
(ур-е Генри)
II: 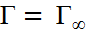
Наиболее важные адсорбенты:
· Полярные (силикогель, алюмогель, иониты –катиониты и аниониты)
· Неполярные – активированный уголь
Применения: очистка воды и катализаторы + природный адсорбент - глина
28) Химическая кинетика. Закон действующих масс. Уравнение Аррениуса.
Химическая кинетика –наука о механизмах химических реакций и закономерностях их протекания во времени.
Закон действующих масс устанавливает влияние концентрации реагирующих в-в на скорость – скорость хим р-ции прямопропорциональна конц-циям реагир-х в-в, возведенных в некоторую степень. Кинетич ур-е р-ции 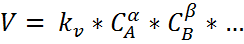 где αА +βВ+…= продукты
где αА +βВ+…= продукты
Уравнение Аррениуса устанавливает зависимость константы скорости химической реакции 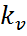 от температуры T.
от температуры T.
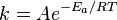 - здесь A характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная, Е – энергия активации р-ции
- здесь A характеризует частоту столкновений реагирующих молекул, R — универсальная газовая постоянная, Е – энергия активации р-ции
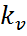 зависит только от природы реакции и темп-ры(не зависит от конц-ций).
зависит только от природы реакции и темп-ры(не зависит от конц-ций).
29) Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость гомогенных и гетерогенных реакций.
Гомогенные реакции – это химические реакции, в которых все в-ва нах-ся в одной фазе. Скорость 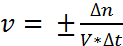 = =[моль/дм^3*с]. Средняя скорость
= =[моль/дм^3*с]. Средняя скорость 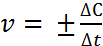
Гетерогенные реакции – либо реагирующие в-ва либо продукты должны образовывать несколько фаз. Скорость 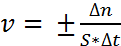 =[моль/м^2*с], S – площадь контакта различных фаз.
=[моль/м^2*с], S – площадь контакта различных фаз.
Факторы влияющие на скорость:
1. Природа реагир-х в-в (основополагающий фактор)
2. Концентрация ЗДМ 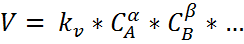 где αА+βВ+…=продукты
где αА+βВ+…=продукты
3. Темп-ра - 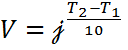 правило Ван Гофа ( при увелич-и на 10
правило Ван Гофа ( при увелич-и на 10  темп-ра ↑ в 2-4 раза – искл: NO+O2=NO2
темп-ра ↑ в 2-4 раза – искл: NO+O2=NO2
4. Наличие посторонних в-в: а) не влияют; б) ↑ с помощью ктализа(катализаторами – гомогенные и гетерогенные). Катал-р ускоряет р-цию но сам не расходуется. в)↓ с помощью ингибирования (ингибиторами)
Факторы влияющие только на скорость гетерогенных:
1. Степень измельчения в-ва
2. Механическое перемешивание
30) Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье.
Химическое равновесие — это термодинамическое равновесие в системе, между компонентами которой происходят химические реакции.
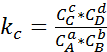 через конц-цию
через конц-цию 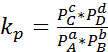 для газов(в атм)
для газов(в атм) 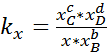 через молярную долю
через молярную долю 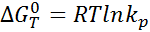
Факторы влияющие на химическое равновесие:
· Температура. При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении в сторону экзотермической (выделение) реакции.
· Общее давление. При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ(хим кол-во), а при понижении в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
· Концентрация/парциальное давление исходных веществ и продуктов реакции. При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции-в сторону исходных веществ.
Принцип Ле Шателье - Если для реакции находящейся в равновесии изменяется какой-либо параметр, то реакция перейдет в новое состояние равновесия, в котором действие внешнего изменения будет уменьшаться.
31) Энтропия системы и ее изменение в различных процессах. Энергия Гиббса как критерий протекания химических процессов.
Энтропия – характеристика вещества, которая характеризует степень внутреннего беспорядка.
Изменение энтропии химической реакции ΔS равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ умноженные каждый на свое кол-во моль.
Энергия Гиббса – это критерий самопроизвольного протекания химической реакции:
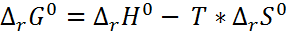
 G<0 – р-ция возможна
G<0 – р-ция возможна  G>0 – невозможна
G>0 – невозможна
 G=0- равновесие
G=0- равновесие
Самопроизвольное протекание химических процессов определяется двумя факторами: 1)стремлением к образованию прочных связей между частицами, более сложных веществ, сопровождающимся уменьшением внутренней энергии системы; 2) стремлением к разъединению частиц, к беспорядку, характеризуемым возрастанием энтропии.
32) Основные законы термохимии и термохимические расчеты.
Термодинамика – это наука, изучающая виды превращения энергии
Химическая термодинамика изучает процесс превращения энергии в химических реакциях
Термохимия (1 раздел хим термодинамики) рассматривает энергетические эффекты хим реакций. с точки зрения термохимии все реакции дел-ся на 2 группы:
· Экзотемические(выделение тепла) Q>0, ∆H<0
· Эндотермические (поглощение тепла) Q<0, ∆H>0 (Q=-H)
H – энтальпия (теплосодержание)
Закон Гесса: Тепловой эффект (∆Н) химической реакции зависит только от природы реагентов и продуктов реакции и не зависит от пути её протекания
Следствия из з-на Гесса:
1. С термохим ур-ями можно проводить арифм действия
2. Тепловой эффект прямой р-ции равен тепловому эффекту обратной с противоположным знаком
3. (и умножить на коэф перед в-во)
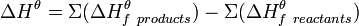
33) Степень окисления. Окислители и восстановители. Окислительно – восстановительные реакции.
Степень окисления — это условный заряд, который приобрел бы атомв случае полной отдачи или полного присоединения эелектронов хим связи.
Окислитель — хим элемент, который присоединяет е и тем самым понижает степень окисления.
Восстановители - хим элемент, который отдает е и тем самым повышвет степень окисления.
Окислительно-восстановительные реакции, ОВР — это реакции, в которых изменяется степень окисления элементов.
Классификация ОВР:
1. Межмолекулярная, в которой меняется степень оксил-я в различных элементах.
2. Межмолекулярная, в которой меняется степень оксил-я одного элемента – конпропорционирование(из разных в одну).
3. Внутримолекулярная ОВР, в которых меняют степени оксил-я атомы различных элементов.
4. Внутримолекулярная ОВР, в которых меняют степени оксил-я атомы одного элемента.= – диспропорционирование(из одного в разные).
Типичные окисл-ли – простые в-ва неМе, гологены, кислород, сера + соедин-е Ме и неМе в ↑ положит степенях
Типичные восстан-ли – простые в-ва Ме, неМе в отриц степени окисл-я, Ме не в макс степени.
34) Окислительно-восстановительный потенциал полуреакций. Уравнение Нернста.
О-в способность того или иного соединения можно определить рассчитав для него велечину о-в потенциала.
Уравнение Нернста: 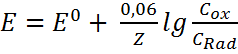
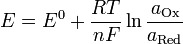 где:
где:
E — электродный потенциал, 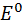 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
R — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
T — абсолютная температура 298К;
F — постоянная Фарадея, равная 96485,35 Кл·моль−1;
n/Z — число электронов, участвующих в процессе;
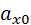 и
и 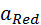 /С— концентрация окис и восстан
/С— концентрация окис и восстан
Факторы, влияющие на Е:
1. Природа (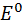 )
)
2. Темп-ра
3. Соотношение конц-ций
4. Протекание побочных реакций(благодаря чему изменяется концентрация)
∆ 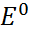 =
= 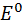 восст(через прямую) -
восст(через прямую) - 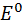 окис(через обратную)
окис(через обратную)
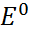 >0 р-ция возможна
>0 р-ция возможна
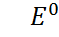 <0 невозможна
<0 невозможна
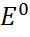 =0 равновесие
=0 равновесие
 2018-01-21
2018-01-21 501
501







