Раздел химии, который посвящен количественному определению тепловых эффектов химических реакций, называется термохимией. Расчет тепловых эффектов реакций, в частности при p = const, основан на двух законах термохимии.
Первый закон термохимии: при разложении соединения на простые вещества происходит изменение энтальпии, равное (но с противоположным знаком) изменению энтальпии при образовании этого соединения из тех же простых веществ. H2+Cl2=2HCl: ΔH°=-186,9 кДж; 2HCl=H2+Cl2: ΔH°=-186,9 кДж. Закон открыт в конце XVIII в. французскими учеными Лавуазье и Лапласом, второе название этого закона - закон Лавуазье-Лапласа. Фактически этот закон вытекает из закона сохранения энергии; именно на этом законе основана формула для расчета энтальпии реакции по энтальпии образования участвующих в ней веществ. Энтальпию образования определить экспериментально можно не для всех веществ из-за сложности проведения или практической неосуществимости многих реакций. Табличные значения ΔH°298 для многих веществ получены расчетным способом, основанном на втором законе термохимии, открытом в 1840 г. русским химиком Г.И. Гессом, закон Гесса: сумма энтальпий двух или более промежуточных реакций (стадий) при переходе от исходного состояния к конечному состоянию равна энтальпии реакции, которая непосредственно ведет от исходного состояния к конечному состоянию. С(графит)+1/2O2(г)=CO(г):ΔH°1; СO(г)+1/2O2(г)=CO2(г): ΔH°2 =>С(графит)+1/2O2(г)=CO2(г) ΔH°3= ΔH°1+ ΔH°2.
Таким образом, энтальпия реакции зависит только от вида и состояния реагентов, но не зависит от промежуточных состояний и пути перехода от реагентов к продуктам (это вторая формулировка закона Гесса). Закон Гесса позволяет связать энтальпийные эффекты процесса, который может протекать в одну или несколько стадий, и тем самым рассчитать энтальпию (тепловой эффект) той реакции, которую трудно осуществить или довести до конца.
Пример. Процесс образования диоксида углерода при сжигании графита в кислороде может протекать двумя путями: 1) 2C + O2 = 2CO; 2CO + O2 = 2CO2 2) C + O2 = CO2 Экспериментально определить энтальпию образования CO по первой реакции невозможно, т.к. идет вторая реакция - превращение CO в CO2. Однако можно экспериментально определить энтальпию реакции превращений CO в CO2 если получить (каким-либо другим способом) чистый CO, а затем перевести его в CO2 сжиганием в кислороде. Кроме того, легко находится и энтальпия полного сгорания графита (путь 2), т.е. энтальпия образования CO2. Отсюда на основе закона Гесса легко рассчитать энтальпию перехода графита в CO.
По закону Гесса ΔH°1 + ΔH°2 = ΔH°3; следовательно:ΔH°(CO)=ΔH°1/n(CO)=(ΔH°3 - ΔH°2)/n(CO)=((-786) - (-566))/2=-110 кДж/моль. Полученное значение точно отвечает справочным данным.
Внутренняя энергия может изменяться только под влиянием внешних воздействий, то есть в результате сообщения системе количества теплоты Q и совершения над ней работы (- А):
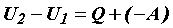
или
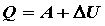 . (11)
. (11)
Это выражение представляет собой закон сохранения энергии в применении к макроскопическим системам и является математической формулировкой I-го начала термодинамики:
количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
 2018-01-21
2018-01-21 835
835








