18. Определите заряд комплексообразователя и его координационное число в комплексном ионе [Fe(C2O4)2(OH)2]3-.
Изобразите графически его структурную формулу.
Классифицируйте этот ион по природе лигандов.
Напишите выражение константы нестойкости.
Решение
1. Пусть заряд иона-комплексообразователя Fe =(Х+). Заряды лигандов равны:(C2O4)2-, (OH)-. Составим уравнение баланса зарядов:
1* (+Х) +2*(-2) +2*(-1) =-3.
Х-4-2+3=0, х=+3
Т.О. заряд комплексообразователя: Fe+3
Координационное число -число связей, образованных комплексообразователем, с лигандами. В данном ионе к.ч. железа равно 6, т.к. 4 связи железо образует с двумя двухвалентными группами C2O4 и две связи – с двумя одновалентными группами ОН)
2. Структурная формула комплексного иона:
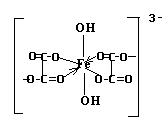
3. Данный ион содержит различные по природе лиганды: оксалат – ион и нидроксид – ион. Т.о. комплексный ион является ацидокомплексом (за счет оксалатов – кислотных остатков щавелевой кислоты) и гидроксокомплексом (за счет гидроксильных групп).
4. Выражение константы нестойкости:
[Fe(C2O4)2(OH)2]3- ↔ Fe3+ + 2 C2O42- + 2 OH -
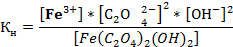
19. Напишите формулу комплексного соединения, имеющего название: хлорид гексаамминхрома (III).
Изобразите графически структурную формулу внутренней сферы.
Классифицируйте соединение по заряду комплексной частицы, по электропроводности, по природе ионов внешней сферы и по природе лигандов.
Рассчитайте координационное число комплексообразователя.
Напишите выражение константы нестойкости.
Решение
1. Хлорид гексаамминхрома (III) имеет молекулярную формулу:
[Cr(NH3)6]Cl3
2. Cтруктурная формула внутренней сферы:
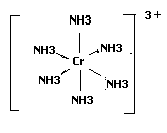
3. П о заряду комплексной частицы хлорид гексаамминхрома является катионным комплексом; по электропроводности –сильным электролитом, по природе ионов внешней сферы-хлоридом, по природе лигандов –аммиакатом
4. Координационное число комплексообразователя равно 6
5. Выражение константы нестойкости:
[Cr(NH3)6]3+ ↔ Cr 3+ + 6 NH3
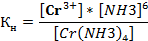
20. Рассчитайте DG процесса [Fe(CN)6]4- ↔ Fe2+ + 6CN-, если Кн в стандартных условиях равна 10-35.
Изобразите графически структурную формулу комплексной частицы.
Классифицируйте её по природе лигандов.
Напишите выражение константы нестойкости.
Решение
1. Изменение свободной энергии Гиббса ΔG и константа равновесия связаны соотношением:
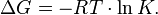
Подставляя данные задачи и учитывая, что стандартные условия соответствуют Т=298 К,получаем:
ΔG=-8,31*298 *ln 10-35=-2,3*8,31*298*lg10-35=-2,3*8,31*298*(-35)=199349 дж=199,349 кДж
2. Структурная формула комплексной частицы:
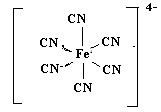
3.По природе лиганда данное соединение является ацидокомплексом, т.к. CN- - кислотный остаток синильной кислоты
4. Выражение константы нестойкости:
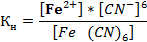
Физико-химия коллоидно-дисперсных систем и растворов ВМС
21. Напишите коллоидно-химические формулы мицелл золей полученных по реакциям:
А) AgNO3 + KI ®
Б) CaCl2 + H2C2O4 →
В) FeCl3 + NaOH ®
Г) FeCl3 + H2O ®
Приведите строение мицелл.
Примечания:
В вариантах А – В необходимо написать формулы мицелл в избытке каждого из исходных веществ.
Решение
1. Коллоидно-химические формулы мицелл золей:
А) AgNO3 + KI ®AgI↓+К NO3
Состав мицеллы, полученной при избытке AgNO3 , может быть представлен следующим образом:
[m AgI *nAg+*(n-x) NO3-]x+ *х NO3-
Строение мицеллы:
Ядро - m AgI *nAg+; адсорбционный слой противоионов -(n-x) NO3-; диффузный слой противоионов - х NO3-.
Состав мицеллы, полученной при избытке KI, может быть представлен следующим образом:
[m AgI *nI-*(n-x) К+]x- *х К+
Строение мицеллы:
Ядро - m AgI *nI-; адсорбционный слой противоионов -(n-x) К+; диффузный слой противоионов - х К+.
Б) CaCl2 + H2C2O4→Са C2O4↓ +2 HCl
Состав мицеллы, полученной при избытке CaCl2 , может быть представлен следующим образом:
[m Са C2O4 *nCa2+*2(n-x) Cl-]2x+ *2х Cl-
Строение мицеллы:
Ядро - m Са C2O4 *nCa2+; адсорбционный слой противоионов 2(n-x) Cl-; диффузный слой противоионов - 2х Cl-
Состав мицеллы, полученной при избытке H2C2O4 , может быть представлен следующим образом:
[m Са C2O4 *n C2O4 2-*2(n-x) H+]2x- *2х H+
Строение мицеллы:
Ядро - m Са C2O4 *n C2O4 2-; адсорбционный слой противоионов 2(n-x) H+; диффузный слой противоионов - 2х H+
В) FeCl3 + 3NaOH ®Fe(OH)3↓ +3NaCl
Состав мицеллы, полученной при избытке FeCl3 , может быть представлен следующим образом:
[m Fe(OH)3*nFe3+*3(n-x) Cl-]3x+ *3х Cl-
Строение мицеллы:
Ядро - m Fe(OH)3*nFe3+; адсорбционный слой противоионов 3(n-x) Cl-; диффузный слой противоионов - 3х Cl-
Состав мицеллы, полученной при избытке NaOH , может быть представлен следующим образом:
[m Fe(OH)3*nОН-* (n-x) Na+]x- *х Na+
Строение мицеллы:
Ядро - m Fe(OH)3*n ОН-; адсорбционный слой противоионов (n-x) Na+; диффузный слой противоионов - х Na+
Г) FeCl3 + 2H2O ® Fe(OH)2Cl+ 2HCl
Fe(OH)2Cl ↔ FeOCl+ H2O
Состав мицеллы, полученной при гидролизе хлорида железа , может быть представлен следующим образом:
[m Fe(OH)3] *nFeO+*(n-x)Cl-}+x*xCl-,
Строение мицеллы:
Ядро - m Fe(OH)3* nFeO+; адсорбционный слой противоионов (n-x) Cl-; диффузный слой противоионов - х Cl-
22. Имеются 3 коллоидных раствора: гидроксида железа (III), полученного гидролизом FeCl3, иодида серебра, полученного в избытке КI, и иодида серебра, полученного в избытке AgNO3.
Предложите два варианта взаимной коагуляции.
Объясните, используя формулы мицелл.
Решение
1.Формулы мицелл:
А)гидроксида железа (III), полученного гидролизом FeCl3:
[m Fe(OH)3 *nFeO+*(n-x)Cl-]+x*xCl-,
Положительно заряженный золь
Б)иодида серебра, полученного в избытке КI:
[m AgI *nI-*(n-x) К+]x- *х К+
Отрицательно заряженный золь
в)иодида серебра, полученного в избытке AgNO3:
[m AgI *nAg+*(n-x) NO3-]x+ *х NO3-
Положительно заряженный золь
2. Взаимная коагуляция наблюдается при сливании растворов противоположно заряженных золей., а именно:
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя иодида серебра, полученного в избытке AgNO3.;
· Отрицательно заряженного золя иодида серебра, полученного в избытке КI, и положительно заряженного золя гидроксида железа (III), полученного гидролизом FeCl3.
23. Пороговая концентрация коллоидного раствора гидроксида алюминия равняется 0,63 ммоль/л.
Рассчитайте объем 0,01М раствора дихромата калия, вызывающего коагуляцию золя объёмом 200 мл.
Определите заряд гранулы, учитывая, что коагулирующим действием обладает дихромат-анион.
Предложите соответствующий вариант формулы мицеллы золя Al(OH)3.
Приведите строение мицеллы.
Решение
1. Рассчитаем объем раствора электролита-коагулятора дихромата калия (V) по формуле:
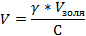
, где γ- пороговая концентрация коллоидного раствора гидроксида алюминия, равна 0,63 ммоль/л, V золя –объем золя, согласно условию равен 0,2 л, С- концентрация электролита-коагулятора дихромата калия, равна 10 ммоль/л. Подставляя значения в формулу, получаем:
V=0,63 ммоль/л *0,2л/10 ммоль/л=0,0126 л=12,6 мл
2.Поскольку коагулирующим действием обладает дихромат-анион, заряд гранулы (коллоидной частицы) противоположен, т.е. положителен.
3. Соответствующий вариант формулы мицеллы золя Al(OH)3, стабилизированного AlCl3:
[m Al(OH)3 *nAl3+*3(n-x)Cl-]+x*3xCl-
3. Строение мицеллы:
Ядро - m Al (OH)3*n Al 3+; адсорбционный слой противоионов 3(n-x) Cl-; диффузный слой противоионов - 3х Cl-
24. ИЭТ альбумина плазмы крови равна 4,64.
Определите знак заряда частиц альбумина в 0,001М растворе HCl.
Укажите направление перемещения частиц альбумина при электрофорезе в данных условиях.
Решение
1.Определим рН в 0,001 М растворе НCl:
рН=-lgC(HCl)=3
2.Так как рН< ИЭТ, частицы альбумина будут заряжены положительно и при электрофорезе будут двигаться к отрицательному электроду (катоду)
 2018-01-21
2018-01-21 4008
4008