1-й способ: за счёт не спаренных электронов, имеющихся невозбужденных взаимодействующих. атомов.
2-ой способ: за счёт перевода спаренного электрона с более низкого энергетического подуровня атома на свободный более высокий энергетический подуровень этого же атома при возбуждении. При этом увеличение числа ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на перевод атома в возбужденное состояние.
3-й способ: донорно-акцепторный механизм. Во многих случаях ковалентная связь возникает за счёт спаренных электронов, имеющихся во внешнем электронном слое одного из атомов и свободной атомной электронной орбитали другого атома. В данном случае ковалентная связь возникает за счёт пары электронов, первоначально принадлежавшей азоту (донору электронов) и свободной атомной электронной орбитали иона водорода (акцептора электронной пары). Общее число ковалентных связей, которые способны создать атом, ограниченно. Оно определяется общим числом валентных орбиталей, т.е. тех орбиталей, использование которых для создания ковалентных связей оказывается энергетически выгодным.
К таким орбиталям относятся S и P внешнего и d – орбитали пред внешнего электронных слоёв. Способность атомов участвовать в образовании ограниченного числа ковалентных связей получило название насыщаемость ковалентной связи.
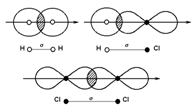 33. Направленность ковалентной связи. Ковалентная связь имеет следующий характер
33. Направленность ковалентной связи. Ковалентная связь имеет следующий характер
– Это σ-связь (s-s, s-p, p-p)
Есть еще π-связь, когда p-p, d-p, p-d. И δ-связь когда d-d.
34. Гибридизация атомных электронных орбиталей. Метод гибридизации атомных электронных орбиталей исходит из предположения, что при образовании молекулы вместо исходных S;P;D электронных облаков образуются такие равноценные (смешанные) или гибридные электронные облака, которые вытянуты по направлению к соседним атомам, благодаря чему достигается их более полное перекрывание с электронными облаками этих атомов. 1) 1s+1p=2sp. Возможны и др случаи гибридизации: 2) 1s+2p=3sp2; 3) 1s+3p=4sp3; 4) 1s+3p+2d=6sp3d2.
35. Основные понятия термодинамики. Термодинамика является математической наукой, занимающейся изучением закономерностей взаимного превращения тепла и других видов энергии, происходящих в системе.
В термодинамике рассматриваются термодинамические системы – это макроскопические объекты, которые могут обмениваться энергией как друг с другом, так и с внешней средой, т.е. телами и полями, которые являются внешними по отношению к данной системе. Системы бывают открытые и закрытые. Для описания состояния термодинамической системы вводят физические величины, которые называют термодинамическими параметрами или параметрами состояния системы (V, P, T). Понятие температура имеет смысл только лишь для равновесных состояний термодинамической системы.
Основным постулатом (нулевым началом термодинамики) является утверждение о том, что предоставленная самой себе макроскопическая система всегда приходит в состояние термодинамического равновесия и остаётся в нём неопределённо долго до тех пор, пока какое-либо воздействие не выведет его из этого состояния.
Равновесное состояние характеризуется:
1) постоянством значения Т во всех точках системы;
2) определённым значением термодинамических параметров.
Скалярная величина, определяющая тепловое равновесие между телами, которые обмениваются энергией по средствам теплообмена называются температурой. Температура тела характеризует кинетическую энергию теплового движения его молекул.
Термодинамические параметры разделяют на внутренние и внешние. Внешние: физические величины, характеризующие состояние системы и зависящие от полей. Внутренние: физические величины, характеризующие состояние системы, и зависящие как от внешних тел, так и от координат и скоростей частиц, образующих данную систему. Если система находится в равновесном состоянии, то параметры состояния не являются независимыми. Они связаны между собой уравнением состояния: P=f(V,T).
Равновесным называют термодинамический процесс, когда система бесконечно медленно проходит непрерывный ряд бесконечно близких термодинамических равновесных состояний.
Изопроцессами называют термодинамические процессы, происходящие в системе с постоянной массой при постоянстве какого-либо термодинамического параметра.
Функцией состояния называют физические величины, характеризующие состояние системы.
Передача энергии от одного тела к другому может осуществляться 2 способами:
1) по средствам механического воздействия;
2) по средствам теплового взаимодействия.
Количество энергии, передаваемой системой, называется работой, совершенной над системой. Количество энергии, переданной системе внешними телами, теплообменом называется количеством тепла или теплом [Дж].
36. Нулевое начало термодинамики. Макроскопическая система предоставленная самой себе всегда приходит в состояние термодинамического равновесия и остаётся в нём неопределённо долго до тех пор, пока какое-либо воздействие не выведет его из этого состояния.
37.Первый закон термодинамики. Количество теплоты сообщаемой системой расходуется на изменение внутренней энергии и на совершение ей работы против внешних сил. ΔQ=ΔU+A => δQ=dU+δA
38. Второй закон термодинамики. Невозможен круговой процесс, единственным результатом которого является превращение всей теплоты, полученной от нагревателя, в эквивалентную ей работу.
Невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к более нагретому.
39. Энтропия. Статистический и термодинамический смысл. Энтропия – есть термодинамическая функция, показывающая, как изменится рассеивание энергии при переходе системы из одного состояния в другое в обратимом изотермическом процессе [Дж / К].
Все макроскопические тела состоят из ограниченного числа микрочастиц. Для исследования свойств и процессов, происходящих в макроскопических системах применяют 2 взаимно дополняющих друг друга метода: молекулярно-статистический и термодинамический.
Статистический метод исходит об атомно-молекулярном строении макрообъектов. Этот метод основан на использовании теории вероятности и определяет модели строения изучаемых систем. В совокупном поведении огромного числа частиц проявляются статистические и динамические закономерности.
Кроме статистического существует ещё термодинамический метод. В нём не учитывают внутреннее строение веществ и характер движения отдельных частиц. Термодинамический метод основан на изучении различных превращений энергии, происходящем в системе.
Достоинством термодинамического метода является то, что его уравнения характеризуются большей общностью и универсальностью. Они применимы к любой системе, для которой справедливы начала термодинамики.
Недостаток: этот метод не скрывает внутренних причин рассматриваемых явлений.
40. Третий закон термодинамики. При любом изотермическом процессе, проведённом при абсолютном нуле температуры, изменение энтропии равно нулю, независимо от изменения любых других параметров состояния.
41.Следствия третьего закона термодинамики. 1)Невозможен такой процесс, в результате которого тело могло быть охлаждено до температуры абсолютного нуля; 2)Теплоёмкость любого тела при приближении к абсолютному нулю температуры стремится к нулю.
42. Превращения энергии при химических реакциях. При реакции химическая энергия превращается в тепло, свет, механическую энергию, электрическую энергию. При химических реакциях может происходить взаимное превращение внутренней энергии веществ с одной стороны и тепловой, лучистой, механической и электрической с другой.
43. Основные понятия термохимии. Реакции, протекающие с выделением тепла – экзотермические, с поглощением – эндотермические. Термохимия – раздел химии изучающий тепловые эффекты реакций. Тепловой эффект реакции – количество теплоты выделяющийся или поглощающаяся в результате осуществления химического процесса. Теплота сгорания топлива – характеризует величину тепла, выделившуюся при сгорания одного моля вещества, при стандартных условиях. Теплота образования вещества – характеризует величину тепла, выделившуюся при образовании одного моля вещества, при стандартных условиях.
44. Первый закон термохимии. Термохимические уравнения. Если при образовании какого-либо соединения выделяется(поглощается) выделяется количество теплоты, то при разложении этого соединения в тех же условиях, такое же количество теплоты поглощается (выделяется).
Термохимические уравнения – уравнения, в котором указаны агрегатные состояния и тепловой эффект.
45. Второй закон термохимии и его следствия. Тепловой эффект зависит от начального и конечного состояний веществ. И не зависит от промежуточных стадий процесса.
Тепловой эффект реакций равен сумме теплот образования получившихся веществ, за вычетом суммы теплот образования исходных веществ.
46.Термодинамические функции: внутренняя энергия, энтальпия. Внутренняя энергия – это полная энергия частиц составляющих данное вещество. Она складывается из потенциальной и кинетической энергий.
Энтальпией пользуются в случае рассмотрения изобарных процессов, а изменения внутренней энергии - при изохорных процессах.
Энтальпия, как и внутренняя энергия характеризует энергетическое состояние вещества, но включает энергию, затрачиваемую на преодоление внешнего давления, т.е. на работу расширения.
Подобно внутренней энергии энтальпия определяется состоянием системы и не зависит от того, каким путём это состояние было достигнуто.
47.Энергия Гиббса. Направленность химических процессов. Для изотермических реакций, протекающих при постоянном давлении такой функцией, которая отражает влияние на направление протекания процесса, как тенденция к уменьшению внутренней энергии, так и тенденции к достижению системы наиболее вероятного состояния является энергия Гиббса. Она связана с энтропией, температурой и энтальпией.
G = H – TS
Таким образом можно записать: dG = dH – TdS. Полезной работой называется вся проведённая в данном процессе работа за вычетом работы расширения: A = pΔV. В условиях постоянства температуры и давления реакции протекают самопроизвольно в сторону уменьшения энергии Гиббса.
48.Скорость химических реакций в гетерогенных и гомогенных системах. Скоростью гетерогенной реакции называется количество вещества, вступающего в реакцию, или образующегося при реакции за единицу времени на единицу площади поверхности раздела фаз.
Скоростью гомогенной реакции называют количество вещества, вступающего в реакцию в результате реакции за единицу времени в единицу объёма рассматриваемой системы.
49.Зависимость скорости реакции от концентрации реагирующих веществ. При постоянной температуре скорость химических реакций прямо пропорциональна произведению концентрации реагирующих веществ.
В случае гетерогенной реакции в уравнении закона действия масс входит концентрация только тех веществ, которые находятся в газовой фазе или растворе, а также величина удельной поверхности раздела фаз.
50. Зависимость скорости химической реакции от природы реагирующих веществ..
Значение величины энергии активации является тем же фактором, по средствам которого сказывается влияние природы реагирующих веществ на скорость реакции.
51. Зависимость скорости химических реакций от температуры. Повышение температуры ускоряет большинство химических реакций. Согласно эмпирическому правилу Вант- Гоффа при повышении температуры на 10 К скорость многих реакций увеличивается в 2 – 4 раза
52. Энергия активации. Активированный комплекс. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества называется энергией активации данной реакции Еа [кДж / моль], а молекулы, обладающие такой энергией называют активными.
Активированный комплекс возникает в качестве промежуточного продукта в ходе как прямой, так и обратной реакции. Энергетически он отличается от исходных веществ на величину энергии активации прямой реакции, а от конечных продуктов – на энергию активации обратной реакции.
53. Катализ. Гомогенный и гетерогенный катализ. Вещества, не расходующиеся в результате протекания реакции, но влияющие на её скорость называются катализаторами.
Явление изменения скорости реакции под действием таких веществ называют катализом. Реакции, протекающие под действием катализаторов, называют каталитическими. В присутствии катализатора реакция проходит через другие промежуточные стадии, чем без него, причём эти стадии энергетически более доступны. При катализе энергия активации реакции понижается. Часть молекул, энергия которых была достаточной для активных столкновений теперь оказывается активной. Катализ снижает энергию активации прямой и обратной реакции на одну и ту же величину.
В случае гомогенного катализа катализатор и реагирующее вещество образуют одну фазу, а в случае гетерогенной – катализатор находится в самостоятельной фазе.
54. Стадии протекания гетерогенных реакций. Стадии:
1) подвод реагирующего вещества к поверхности;
2) химическая реакция на поверхности;
3) отвод продукта реакции от поверхности.
При установившемся режиме реакции все 3 стадии протекают с равными скоростями, т.е. скорость реакции будет определяться скоростью протекания самой медленной стадии. Стадия, определяющая скорость протекания гетерогенной реакции называется лимитирующей стадией.
55. Цепные реакции. Существуют реакции, в которых возможность протекания каждого элементарного акта сопряжена с успешным исходом предыдущего акта и в свою очередь обуславливает возможность последующего. Такие реакции называют цепными.
Цепные реакции протекают с участием активных центров – атомов, ионов, радикалов, обладающих не спаренными электронами и проявляющие вследствии этого очень высокую реакционную активность. Активные центры служат создателями цепей последовательных превращений веществ.
Такие реакции называются неразветвлёнными. В случае разветвлённых цепных реакций взаимодействие одного свободного радикала с молекулой исходного вещества приводит к образованию не одного, а двух и большего числа новых активных центров. Один из них продолжает старую цепь, а другие – дают начало новым. Цепь разветвляется и реакция прогрессивно ускоряется.
56. Необратимые и обратимые реакции. Необратимые реакции могут протекать только в прямом направлении, а обратимые и в обратном.
Многие реакции обратимы уже в обычных условиях, это означает, что в заметной степени протекает обратная реакция. Например, если попытаться нейтрализовать щелочью водный раствор очень слабой хлорноватистой кислоты, то окажется, что реакция нейтрализации до конца не идет и раствор имеет сильнощелочную среду. Это означает, что реакция HClO + NaOH  NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением): RCOOH + R'OH
NaClO + H2O обратима, т.е. продукты этой реакции, реагируя друг с другом, частично переходят в исходные соединения. В результате раствор имеет щелочную реакцию. Обратима реакция образования сложных эфиров (обратная реакция называется омылением): RCOOH + R'OH  RCOOR' + H2O, многие другие процессы.
RCOOR' + H2O, многие другие процессы.
Как и многие другие понятия в химии, понятие обратимости во многом условно. Обычно необратимой считают реакцию, после завершения которой концентрации исходных веществ настолько малы, что их не удается обнаружить (конечно, это зависит от чувствительности методов анализа). При изменении внешних условий (прежде всего температуры и давления) необратимая реакция может стать обратимой и наоборот. Так, при атмосферном давлении и температурах ниже 1000° С реакцию 2Н2 + О2 = 2Н2О еще можно считать необратимой, тогда как при температуре 2500° С и выше вода диссоциирует на водород и кислород примерно на 4%, а при температуре 3000° С – уже на 20%.
 2018-01-21
2018-01-21 2922
2922
