Согласно современным представлениям, необходимым условием для образования химической связи между двумя атомами является перекрывание облаков их электронов. Электрон образует связь в том направлении, в котором расположена наибольшая часть его облака, так что при этом осуществляется максимальное перекрывание облаков двух связующих электронов.
В случае простой связи (изображаемой одной валентной черточкой) максимальное перекрывание осуществляется по прямой, соединяющей два атома. Такая простая кова-лентная связь называется σ-связью, а электроны, ее образующие, — σ-электронами.
В молекуле этилена, как это установлено с помощью физических методов исследования, пять σ-связей расположены друг относительно друга под углом 120° и находятся в одной плоскости:
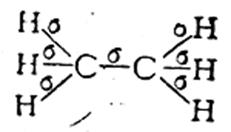
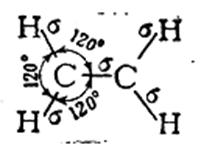
Однако при таком расположении связей в этилене у каждого атома углерода остается по одному неспаренному электрону. Они уже не могут образовать между атомами углерода вторую σ-связь, так как это сопровождалось бы нарушением принципа Паули. Поэтому такие неспаренные электроны атомов углерода образуют качественно иную связь. Перекрывание двух электронных облаков происходит так, что восьмерки этих облаков перпендикулярны плоскости, в которой расположены все шесть атомов молекулы этилена. Такая связь называется π-связью, а электроны, ее образующие, — π-электронами.
Двойная углерод – углеродная связь С=С состоит из σ-связиπ-связи.
Тройная углерод-углеродная связь С≡С состоит из σ-связи, возникающей при перекрыванииsp-гибридных орбиталей, и двух π-связей.
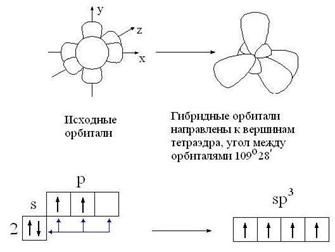
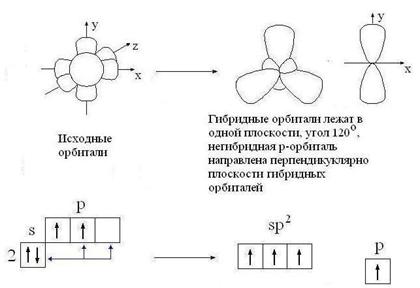
Гибридизация - это взаимодействие атомных орбиталей с близкими значениями энергии, сопровождающееся образованием новых 'гибридных' орбиталей.
Гибридизация - процесс, требующий затрат энергии, но эти затраты с избытком компенсируются за счет энергии, выделяющейся при образовании большего числа ковалентных связей.образующиеся 'гибридные' орбитали имеют форму ассимметричной гантели и резко отличаются от исходных орбиталей атома углерода.
Для атома углерода возможно три типа гибридизации:
sр3-гибридизация - взаимодействующиеорбитали показаны стрелками:
sр2-гибридизация:
sр-гибридизация:

Гибридные орбитали атома углерода способны участвовать в образовании только σ-связей, незатронутые гибридизацией р-орбитали образуют только π-связи. Именно этой особенностью определяется пространственное строение молекул органических веществ.
5. Делокализованная химическая связь: π, π- и р, π-сопряжение (бутадиен-1,3; хлорэтен).
Сопряжение – перераспределение (выравнивание) электронной плотности в сопряженной системе, приводящее к стабилизации молекулы.
Сопряжение возможно только в том случае, если все атомы, принимающие участие в этом процессе расположены в одной плоскости, т.е. должно выполняться условие копланарности.
Различают сопряженные системы с открытой цепью и замкнутые сопряженные системы. Возможны два типа сопряжения π,π-сопряжение (в сопряжении участвуют π-электроны кратной связи) и р,π-сопряжение (в сопряжении участвуют π-электроны кратной связи и р-электроны неподеленной электронной пары гетероатомов –N–, –O–, –S–).
Сопряжение – это энергетически выгодный процесс, происходящий с выделением энергии, поэтому для сопряженных систем характерна повышенная термодинамическая устойчивость. Количественно термодинамическую устойчивость можно оценить как разность энергий соединений с сопряженными двойными связями и соединений с изолированными двойными связями. Эту разность называют энергией сопряжения или энергией делокализации. Термодинамическая устойчивость соединения увеличивается с увеличением длины сопряженной цепи. Из сопряженных полиенов наиболее широко распространены в природе каратиноиды(каротин, витамин А, ретиналь).
Простейшей π,π-сопряженной системой этого типа является бутадиен-1,3, а р,π-сопряженной является хлорэтен.
Все атомы углерода находятся в sp2-гибридизации, все s связи лежат в одной плоскости, четыре негибридизованныеРz-орбитали расположены перпендикулярно плоскости s-связей и параллельны друг другу (необходимое условие для перекрывания).
Н2С = СН – СН = СН2 Н2С = СН –Cl
бутадиен-1,3 хлорэтен
 2018-01-21
2018-01-21 7750
7750
