Общая формула ароматических углеводородов CnH2n-6.
Простейшее ароматическое соединение — бензол.
Его молекула С6Н6 содержит 6 атомов углерода и 6 атомов водорода, следовательно, не все связи атомов углерода насыщены атомами водорода.
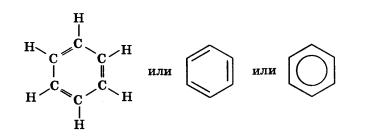
Он представляет собой бесцветную жидкость со своеобразным запахом, который, однако, нельзя назвать приятным. Бензол легче воды (плотность 0,88 г/см3), температура кипения 80,4 °С, практически нерастворим в воде.
Единой характеристики, позволяющей надежно классифицировать соединение как ароматическое или неароматическое не существует. Основными характеристиками ароматических соединений являются:
· склонность к реакциям замещения, а не присоединения (определяется легче всего, исторически первый признак, пример — бензол, в отличие от этилена не обесцвечивает бромную воду)
· выигрыш по энергии, в сравнении с системой несопряженных двойных связей.
· наличие кольцевого магнитного тока
· наличие самой плоскости (минимально искаженной), в которой лежат все (либо не все — гомоароматичность) атомы образующие ароматическую систему.
· практически всегда соблюдается Правило Хюккеля: ароматичной может быть лишь система, содержащая (в кольце) 4n+2 электронов (где n = 0, 1, 2, …). Система, содержащая 4n электронов является антиароматичной.
Кроме бензольного кольца и его конденсированных аналогов ароматические свойства проявляют многие гетероциклы — гетарены: пиррол, фуран, тиофен, пиридин, индол, оксазол и другие. При этом в сопряженную систему шестичленныхгетероцикловгетероатом отдает один электрон (по аналогии с углеродом), в 5-атомных — неподеленную электронную пару
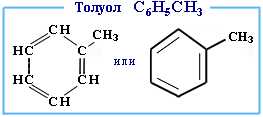
Толуо́л —метилбензол, бесцветная жидкость с характерным запахом, относится к аренам.Бесцветная подвижная летучая жидкость с резким запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных пределах с углеводородами, многими спиртами и эфирами, не смешивается с водой. Горюч, сгорает коптящим пламенем.
Анили́н (фениламин) — органическое соединение с формулой C6H5NH2, простейший ароматический амин. Представляет собой бесцветную маслянистую жидкость с характерным запахом, немного тяжелее воды и плохо в ней растворим, хорошо растворяется в органических растворителях. На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит. Для анилина характерны реакции как по аминогруппе, так и по ароматическому кольцу. Особенности этих реакций обусловлены взаимным влиянием атомов. Например, анилин энергично реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок).
Пиридин (C5H5N) — шестичленный ароматический гетероцикл с одним атомом азота, бесцветная жидкость с резким неприятным запахом; смешивается с водой и органическими растворителями. Пиридин — слабое основание, дает соли с сильными минеральными кислотами, легко образует двойные соли и комплексные соединения.
Пиррол (C4H4NH) — ароматический пятичленный азотистый гетероцикл, обладает слабыми кислотными свойствами. Содержится в костном масле (которое получают при сухой перегонке костей), а также в каменноугольной смоле. Пиррольные кольца входят в состав порфиринов — хлорофилла растений, гема гемоглобинов и цитохромов и ряда других биологически важных соединений.
Тиофен (C4H4S) относится к π-избыточным гетероароматическим системам и обладает выраженными ароматическими свойствами. В реакциях электрофильного замещения (галогенирование, нитрование, формилирование, дейтерирование и др.) тиофен значительно активнее бензола (в некоторых случаях в 104 раз). Реакции идут обычно (иногда исключительно) в α-положение цикла.
Фуран — органическое соединение с формулой C4H4O. Пятичленныйгетероцикл с одним атомом кислорода. Представляет собой бесцветную жидкость с характерным запахом. Фуран является ароматическим соединением с шестью p-электронами.
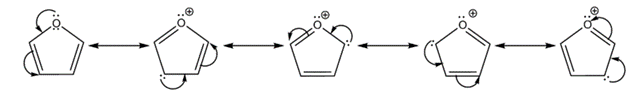
Электронодонорные заместители повышают электронную плотность кольца и увеличивают скорость реакции электрофильного замещения, такие заместители называют активирующими
При взаимодействии, например, толуола с электрофилом атака в орто- и пара-положенияприводит к большей стабилизации интермедиата, а при атаке в мета-положении такой компенсации не происходит
Электроноакцепторные заместители понижают электронную плотность кольца и уменьшают скорость реакции, их называют дезактивирующими
Электроноакцепторные заместители, например, нитрогруппа, дестабилизируют все три возможных σ-комплекса, возникающий при атаке в мето-пложениедестабилизироан в меньшей степени.
8. Современная теория кислот и оснований Бренстеда-Лоури. Сила кислот и оснований (рКа и рКв).
В 1923 г. Бренстед и Лоури выдвинули новую теорию кислот и оснований, основанную на представлении о переносе протона. Согласно этой теории, кислота представляет собой вещество, состоящее из молекул или ионов-доноров протонов (т. к. они отдают протоны), а основание-вещество, состоящее из молекул или ионов-акцепторов протонов (т.к. они принимают протоны).
В случае слабой кислоты, как, например, уксусная кислота, молекулы кислоты лишь частично диссоциированы в водном растворе, так что в нем устанавливается равновесие
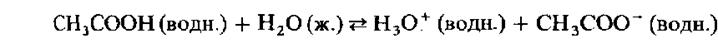
Каждая молекула соляной кислоты и уксусной кислоты может донировать только по одному протону. Поэтому они называются однопротонными или одноосновными кислотами (последнее название объясняется тем, что каждая такая кислота имеет только одно сопряженное основание; см. ниже).
Кислота, способная донировать более одного протона, называется многопротонной или многоосновной. Например, серная кислота является двухпротонной, потому что она может донировать два протона. Ее называют также двухосновной, потому что она имеет два сопряженных основания, HSO4- и SO4-; процесс растворения серной кислоты в воде можно представить двумя уравнениями:
H2SO4(ж.) + H2O (ж.) = H3O+ (водн.) + HSO4 (водн.) или
H2SO4(ж.) + 2H2O(ж.) = 2H3O+ (водн.) + SO2." (водн.)
Сильные основания, такие, как гидроксиды щелочных металлов, полностью ионизируются в воде:
NaOH(TB.) + H2O = Na+(водн.) + ОН- (водн.)
Эти вещества являются основаниями, потому что гидроксидные ионы могут акцептировать (присоединять) ионы водорода:
ОН- (водн.) + H3O+ (водн.) = 2H2O (ж.)
Сила кислот определяется константой равновесия их взаимодействия с водой как основанием, например:
CH3COOH + H2O = CH3COO- + H3O+
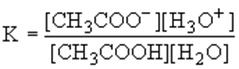
Так как в разбавленных растворах [H2O]=const, то ее можно внести в константу равновесия, которую называют константой кислотности:
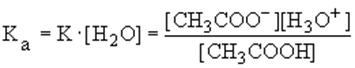
На практике чаще пользуются величинами pKa= - lg Ka. Чем меньше величина pKa, тем сильнее кислота.
Сила оснований определяется константой равновесия взаимодействия их с водой как кислотой:
RNH2 + H2O = RNH3+ + OH-
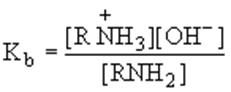 - константа основности.
- константа основности.
 2018-01-21
2018-01-21 4639
4639








