Кондуктометрия (от англ. conductivity — электропроводность и метрия) — совокупность электрохимических методов анализа, основанных на измерении электропроводности растворов.
Кондуктометрия применяется для определения концентрации растворов солей, кислот, оснований, для контроля состава некоторых промышленных растворов.
Кондуктометрический анализ основан на изменении концентрации вещества или химического состава среды в межэлектродном пространстве; он не связан с потенциалом электрода, который обычно близок к равновесному значению. Кондуктометрия включает прямые методы анализа (используемые, например, в солемерах) и косвенные (например, в газовом анализе) с применением постоянного или переменного тока (низкой и высокой частоты), а также хронокондуктометрию, низкочастотное и высокочастотное титрование.
Классификация кондуктометрических методов анализа: прямая кондуктометрия, низкочастотное титрование; высокочастотное титрование.
Метод Коултера: Метод первоначально использовался для подсчета клеток крови, позволившие использовать этот метод также для определения объема клетки. Принцип действия заключается в том, что между двумя электродами, помещенными в два разделенных резервуара, которые связаны стеклянной чувствительной зоной (отверстие), протекает постоянный ток. Ртутный сифон временно выводится из равновесия с помощью вакуума. При закрывании крана суспензия засасывается через отверстие за счет возвращения ртути в равновесие. Электрические контакты замыкаются ртутью при прохождении через отверстие определенного точного количества суспензии. При этом изменяется сопротивление электролита, что вызывает колебания напряжения, пропорциональные объему частиц. Эти вызванные частицами колебания усиливаются и подсчитываются в измерительном контуре. Калибровка прибора выполняется для определенного раствора электролита, который используется обычно со стандартными монодисперсными латексами с известным диаметром частиц. При наличии откалиброванного таким образом прибора со стандартным латексом, константа k будет сохраняться для всех других пороговых размеров при использовании того же электролита.
|
|
|
Осмос. Осмотическое давление: закон Вант-Гоффа. Осмотические свойства растворов электролитов. Осмоляльность и осмолярность биологических жидкостей. Гипо-, гипер- и изотонические растворы. Изотонический коэффициент. Понятия об изосомии (электролитный гомеостаз). Роль осмоса в биологических системах. Плазмолиз и цитолиз.
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
|
|
|
Осмотическое давление (обозначается π) — избыточное гидростатическое давление на раствор, отделённый от чистого растворителя полупроницаемой мембраной, при котором прекращается диффузия растворителя через мембрану. Это давление стремится уравнять концентрации обоих растворов вследствие встречной диффузии молекул растворённого вещества и растворителя. 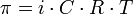 , где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора.
, где i — изотонический коэффициент раствора; C — молярная концентрация раствора, выраженная через комбинацию основных единиц СИ, то есть, в моль/м3, а не в привычных моль/л; R — универсальная газовая постоянная; T — термодинамическая температура раствора.
ЗАКОН ВАНТ-ГОФФА описывает зависимость ОСМОТИЧЕСКОГО ДАВЛЕНИЯ разбавленных растворов от температуры и молярной концентрации раствора:
Вант-Гофф выразил осмотическое давление формулой РV = iRT, где Р означает осмотическое давление вещества, растворенного в жидкости; V – объем; R – газовую постоянную; Т – температуру и i – коэффициент, который для газов часто равен 1, а для растворов, содержащих соли, – больше единицы.
растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания, осмотическое давление для них всегда больше, чем вычисленные. Для учета этих отклонений Вант-Гофф внес в уравнение для растворов электролитов поправку – изотонический коэффициент i:
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
Осмотические свойства растворов электролитов (на примере эритроцитов)
Содержание белков в эритроцитах выше, а низкомолекулярных веществ - ниже, чем в плазме. Осмотическое давление, создаваемое высокой внутриклеточной концентрацией белков, в значительной степени компенсируется малой концентрацией низкомолекулярных веществ, и поэтому осмотическое давление в эритроцитах лишь немногим выше, чем в плазме: величина его как раз достаточна для обеспечения нормального тургора этих клеток. Мембрана эритроцита пропускает низкомолекулярные вещества, причем проницаемость ее для разных ионов различна. Благодаря проницаемости при угнетении активного транспорта ионов (натрия - из клетки, калия - в клетку) снижается их трансмембранный концентрационный градиент. Высокое внутриклеточное содержание белков, которое при этом остается постоянным, перестает компенсироваться, и осмотическое давление в эритроците возрастает. В результате вода начинает поступать в эритроцит и поступает до тех пор, пока он не лопнет и гемоглобин не выйдет в плазму. Эо так называемый осмотический гемолиз. Если внеклеточная жидкость лишь умеренно гипотонична, эритроциты набухают и приобретают форму, близкую к сферической. В гипертоническом растворе эритроциты теряют воду и сморщиваются.
Осмос играет важнейшую роль в процессах жизнедеятельности животных и растений, поскольку клеточная плазматическая мембрана является полупроницаемой. Осмос обусловливает поднятие воды по стеблю растений, рост клетки и многие другие явления.
Рассмотрим роль осмоса в водном режиме растительной клетки. Осмотическое давление жидкости, контактирующей с клеткой, может быть больше, меньше либо равно осмотическому давлению внутриклеточной жидкости. Соответственно выделяют гипертонические, гипотонические и изотонические растворы.
Если клетка находится в контакте с гипертоническим раствором ( растворы, осмотическое давление которых выше осмотического давления в растительных или животных клетках и тканях), вода выходит из неё путём осмоса через плазматическую мембрану. Протопласт (живое содержимое клетки) при этом уменьшается в объёме, сморщивается и, в конце концов, отстаёт от клеточной стенки. Этот процесс называют плазмолизом. Процесс плазмолиза обычно обратим.
|
|
|
Цитолиз — процесс разрушения клеток эукариот выражающийся в виде их полного или частичного растворения под действием лизосомальных ферментов. Цитолиз может быть как частью нормальных физиологических процессов, например при эмбриогенезе, так и патологическим состоянием возникающим при повреждении клетки внешними факторами, например при воздействии на клетку антител.
Например в организме человека цитолиз гепатоцитов может развиваться при гепатите. Как результат воздействия антител на пораженные вирусом клетки печени.
Если клетку поместить в чистую воду или гипотонический раствор (р азличные растворы, осмотическое давление которых ниже, чем в клетках растительных или животных тканей.), вода путём осмоса поступает в клетку; протопласт при этом увеличивается в объёме и оказывает давление на сравнительно жёсткую клеточную стенку. Этот процесс называется тургором. Тургорное давление препятствует дальнейшему поступлению воды в клетку. Именно тургорное давление поддерживает стебли растений в вертикальном положении, придаёт растениям прочность и устойчивость.
Изотонические растворы ( растворы с одинаковым осмотическим давлением; в биологии и медицине — природные или искусственно приготовленные растворы с таким же осмотическим давлением, как и в содержимом животных и растительных клеток, в крови и тканевых жидкостях.) не оказывают влияния на водный режим клетки.
У животных клеток нет клеточной стенки, поэтому они более чувствительны к осмотическому давлению жидкости, в которой находятся.
Изоосмия, изотония (от изо... и греч. osmós — толчок, tónos — напряжение), относительное постоянство осмотического давления в жидких средах и тканях организма, обусловленное поддержанием на данном уровне концентраций содержащихся в них веществ: электролитов, белков и т. д.. Изоосмия — одна из важнейших физиологических констант организма, обеспечиваемых механизмами саморегуляции. Отклонение осмотического давления от нормального физиологического уровня» 0,76—0,81 Мн/м2 (7,6—8,1 ат) влечёт за собой нарушение обменных процессов между кровью и тканевой жидкостью.
|
|
|
Осмолярность – сумма концентраций катионов анионов и неэлектролитов, т.е. всех кинетически активных частиц в 1л. раствора. Она выражается в миллиосмолях на литр (мосм/л).
Осмоляльность – концентрация тех же частиц, растворенных в килограмме воды, выражающаяся в миллиосмолях на килограмм (мосм/кг).
Показатели осмолярности в норме
Плазма крови – 280-300
СМЖ – 270-290
Моча – 600-1200
Индекс осмолярности – 2,0-3,5
Клиренс свободной воды – (-1,2) – (-3,0) мл/мин
 2018-01-21
2018-01-21 1751
1751








