Сірка — досить поширений елемент. В природі вона зустрічається як у вільному стані — так звана самородна сірка, але значно частіше сірка зустрічається в зв'язаному вигляді. ↓Сірка належить до головної підгрупи шостої групи. Маючи в зовнішньому шарі шість електронів:—атоми сірки проявляють властивості окисника і, приєднуючи від атомів Інших елементів два недостаючі їм електрони, перетворюються в негативно двовалентні іони:S0+2е=S2-.Але сірка менш активний окисник, ніж кисень, оскільки її валентні електрони віддаленіші від ядра атома і слабіше з ним зв'язані, ніж валентні електрони атомів кисню. На відміну від кисню сірка може проявляти властивості і відновника:S0—6e=S6+абоS0—4e=S4+. Відновні властивості сірки виявляються при взаємодії її з сильнішим від неї окисником. ↓ Сірка може безпосередньо реагувати майже з усіма металами (за винятком благородних), але переважно при нагріванні. Так, якщо суміш порошків сірки й заліза нагріти хоч в одному місці, щоб почалася реакція, то далі уся суміш сама собою розжариться (за рахунок теплоти реакції) і перетвориться в чорну крихку речовину—моносульфід заліза:Fe + S = FeS. ↓ Суміш порошків сірки й цинку при підпаленні реагує дуже бурхливо, із спалахом. Внаслідок реакції утворюється сульфід цинку: Zn + S = ZnS При високій температурі сірка реагує також з воднем з утворенням сірководню: H2 + S = H2S. ↓ При взаємодії з металами і воднем сірка відіграє роль окисника. Сірка порівняно легко реагує і з киснем. S + O2 = SO2 2S + 3O2 = 2SO3 При цьому окисником є кисень, а сірка — відновником.
Сульфінатна кислота (сірчиста кислота) — хімічна сполука, яка має формулу H2SO3, нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді.
Ніяких підтверджень її існуванню немає, але є факти утворення молекули в газовій формулі[1].Слабка двухосновна кислота, існує тільки у водному розчині, дуже нестійка. Розчиняючись у воді, сульфітний ангідрид поступово взаємодіє з водою, утворюючи сульфітну кислоту: 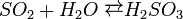
Утворює два ряди солей: середні — сульфіти і кислі — бісульфіту. Сірчиста кислота та її солі є відновниками. При взаємодії з ще сильнішими відновниками сірчиста кислота грає роль окиснювача 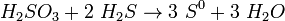 При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти:
При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти: 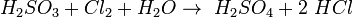
 2018-01-21
2018-01-21 745
745








