Існує 2 види оксидів сірки. 1)Діоксид сірки SO2 -при звичайних умовах являє собою безбарвний газ, з різким задушливим запахом. Він важчий від повітря більше ніж у два рази.
Діоксид сірки займає проміжне положення в ряду окиснення — відновлення сірки. Сірка в ньому позитивно чотиривалентна. Тому атом сірки в молекулі SO2 може або віддавати ще два електрони, або приєднувати чотири чи шість електронів. Отже, в залежності від умов діоксид сірки може бути відновником або окисником. S4+О2 + I02+ H2O = H2S6+О4 + 2HJ- - з окосниками
S4+O2 + 2H2S2- = 3S0 ↑ + 2H2O – з відновниками.
риоксид сірки (сульфатний ангідрид) - SO3. При звичайних умовах триоксид сірки SO3 це безбарвна рухлива рідина зі специфічним запахом, яка при 44,8°С кипить, а при 16,8°С переходить у прозору кристалічну масу. Триоксид сірки — надзвичайно сильний окисник. Так, фосфор у дотику з SO3 спалахує. З водою він енергійно реагує з утворенням сульфатної кислоти: SO3 + H2O = H2SO4
Сульфатна кислота -сполука сірки з формулою H2SO4.Безбарвна масляниста, дуже в'язка і гігроскопічна рідина.Сірчана кислота одна з найсильніших неорганічних кислот і є дуже їдкою та небезпечною. Ця кислота утворює два ряди солей: сульфати і гідрогенсульфати, в яких у порівнянні з сульфатною кислотою замінюються один або два аніони гідрогену на катіони металів.
Як двохосновна сульфітна кислота H2SO3 може утворювати два ряди солей: а) середні солі — сульфіти і б) кислі солі — гідросульфіти (продукти неповного заміщення Гідрогену кислоти на метал). NaOH + SO2 = NaHSO3 та 2NaOH +SO2 = Na2SO3 + H2O
Сульфінатна кислота (сірчиста кислота) — хімічна сполука, яка має формулу H2SO3, нестійка кислота, що утворюється при розчинені діоксиду сірки у воді. Існує лише у водному розчині, і тому не виділена в чистому вигляді.
Ніяких підтверджень її існуванню немає, але є факти утворення молекули в газовій формулі[1].Слабка двухосновна кислота, існує тільки у водному розчині, дуже нестійка. Розчиняючись у воді, сульфітний ангідрид поступово взаємодіє з водою, утворюючи сульфітну кислоту: 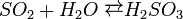
Утворює два ряди солей: середні — сульфіти і кислі — бісульфіту. Сірчиста кислота та її солі є відновниками. При взаємодії з ще сильнішими відновниками сірчиста кислота грає роль окиснювача 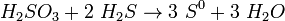 При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти
При взаємодії з хлором вона легко відновлює його до хлороводневої кислоти, а сама окиснюється до сульфатної кислоти 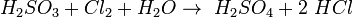 .
.
У сільському господарстві сірковий цвіт застосовують для боротьби з шкідниками бавовнику і виноградної лози.
 2018-01-21
2018-01-21 645
645








