mA+nB↔pC+qD,
которая протекает при постоянных давлении и температуре. В ходе реакции число молей исходных веществ А и В уменьшается, а число молей продуктов реакции C и D увеличивается.
. Химическое равновесие это состояние системы, при котором скорость прямой реакции равна скорости обратной реакции. применив закон действия масс, зависимость прямой и обратной реакции от концентрации реагирующих веществ определяется выражениями:
vпр.= k пр.[А]m[В]n, vобр.= k обр.[С]p[D]q и при vпр.= vобр. получим что


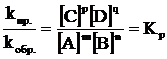 .
. 
Величина Кр называется константой химического равновесия и она связана с изменением энергии Гиббса следующим уравнением:
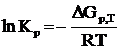
Химическое равновесие не является статическим, т. е. состоянием покоя. При изменении внешних условий равновесие сдвигается и возвращается в исходное состояние, если внешние условия приобретают постоянные значения.. Влияние на химическое равновесие внешних факторов вызывает его смещение. Направление смещения подчиняется принципу Ле-Шателье:
Если на систему, находящуюся в состоянии химического равновесия, оказать какое-либо воздействие, то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено.
Следствие 1. При увеличении температуры равновесие смещается в сторону эндотермической реакции, а при уменьшении – в сторону экзотермической.
Следствие 2. При увеличении давления в газовых смесях равновесие смещается в сторону образования меньшего числа молей газов, а при увеличении давления – в сторону образования большего числа молей газов.
Следствие 3. При увеличении концентрации какого либо компонента системы равновесие смещается в сторону расхода этого компонента.
Пример 1. При некоторой температуре константа диссоциации йодовродорода на простые вещества равна 6,25·10-2. Какой процент HI диссоциирует при этой температуре?
Решение. Уравнение диссоциации HI:
2HI↔H2+I2
Обозначим начальную концентрацию HI через С(моль/л). Если к моменту наступления равновесия из каждых С молей йодоводорода диссоциировало х молей, то при этом, согласно уравнения реакции, образовалось 0,5 молей водорода и йода соответственно. Таким образом, равновесные концентрации составляют:
[HI]=(C-x) моль/л; [H2]=[I2]=0,5х моль/л
Подставим эти значения в выражение константы равновесия реакции:
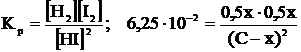
откуда х=0,333С.
Ответ: 33,3%
Пример 2. В каком направлении сместится равновесие в системах
а) СО(г.)+Сl2(г.)↔СОСl2(г.)
б) 2HI(г.)↔H2(г.)+I2(г.)
если при неизменной температуре увеличить давление газовой смеси.
Решение. а) Протекание реакции в прямом направлении приводит к уменьшению общего числа молей газов, т.е. к уменьшению давления в системе. Поэтому, согласно принципу Ле-Шателье, повышение давления вызовет смещение равновесия в сторону прямой реакции.
б) Протекание реакции не сопровождается изменением числа молей газов, и изменение давления не вызовет смещение равновесия в системе.
Пример 3. Используя справочные данные, найти значение температуры, при которой константа равновесия реакции образования водяного газа равна единице. С(графит)+Н2О(г.)↔СО(г.)+Н2(г.)
Решение. Из уравнения lnKp= 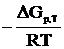 следует, что при Кр=1 стандартная энергия Гиббса химической реакции равна нулю. Тогда из соотношения
следует, что при Кр=1 стандартная энергия Гиббса химической реакции равна нулю. Тогда из соотношения 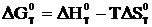 вытекает, что
вытекает, что 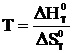 . Воспользовавшись табличными данными находим, что ΔН=131,3 кДж, а ΔS=0,1336 кДж/К, отсюда Т=131,3/0,1336=983 К.
. Воспользовавшись табличными данными находим, что ΔН=131,3 кДж, а ΔS=0,1336 кДж/К, отсюда Т=131,3/0,1336=983 К.
Ответ: 983 К.
Контрольные задания.
76. В системе А(г.)+2В(г.)=С(г.) равновесные концентрации равны: [А]=0,06 моль/л; [В]=0,12 моль/л; [С]=0,216 моль/л. Найти константу равновесия реакции и концентрации веществ А и В.
77. Рассчитать константу равновесия реакции: 2SO3/г/«2SO2/г/+О2/г/., пользуясь справочными данными DG.
78. В закрытом сосуде установилось равновесие: СО2(г.)+Н2(г.)↔СО(г.)+Н2О(г.); константа равновесия равна единице. Определить: а) сколько процентов СО2 подвергнется превращению в СО при данной температуре, если смешать 1 моль СО2 и 5 молей Н2? б) в каких объёмных соотношениях были смешаны СО2 и Н2, если к моменту наступления равновесия в реакцию вступило 90% первоначального количества водорода?
79. При состоянии равновесия в системе N2(г.)+3Н2(г.)↔2NН2(г.); ΔН0=-92,4 кДж, концентрации участвующих веществ равны: [N2]=3 моль\л; [Н2]=9 моль\л; [NН3]=4 моль\л. Определить: исходные концентрации водорода и азота; б) в каком направлении сместится равновесие с ростом температуры? в) в каком направлении сместится равновесие с повышением давления?
80. Константа равновесия реакции FеО(к.)+СО(г.)↔Fе(к.)+СО2(г.) при некоторой температуре равно 0,5. Найти равновесные концентрации СО и СО2, если начальные концентрации составляли соответственно 0,05 и 0,01 моль\л.
81. Для реакции Н2(г.)+Br2(г.)↔2НВr(г.) при некоторой температуре Кр=1. Определить состав (в процентах по объёму) равновесной реакционной смеси, если исходная смесь состояла из трёх молей водорода и двух молей брома.
82. Константа равновесия реакции А(г.)+В(г.)↔С(г.)+D(г.) равна единице. Сколько процентов вещества А подвергнется превращению, если смешать 3 моля вещества А и 5 молей вещества В.
83. После смешивания газов А и В в системе А(г.)+В(г.)↔С(г.)+D(г.) устанавливается равновесие при следующих концентрациях: [А]=0,05 моль\л, [С]=0,02 моль\л. Константа равновесия равна 4·10-2. Найти исходные концентрации веществ А и В.
84. Найти константу равновесия реакции N2О4↔2NО2, если начальная концентрация N2О4 составляла 0,08 моль\л, а к моменту наступления равновесия диссоциировало 50% молекул N2О4.
85. В каком направлении сместятся равновесия
2Н2(г.)+О2(г.)↔2Н2О(г.), ΔН0= -483,6 кДж
СаСО3(к.)↔СаО(к.)+СО2(г.) ΔН0= 179 кДж
а) при повышении давления; б) при повышении температуры.
Ответ обосновать.
86. В каком направлении сместятся равновесия
2СО(г.)+О2(г.)↔2СО2(г.), ΔН0= -556 кДж
N2(г.)+О2(г.)↔2NО(г.) ΔН0= 180 кДж
а) при понижении температуры; б) при повышении давления.
Ответ обосновать.
87. Пользуясь табличными данными, вычислить константы равновесия следующей реакции при 298 К и при 1000К. СО(г.)+Н2О(г.)↔СО2(г.)+Н2 (г.)
88. Вычислить температуру, при которой константа равновесия реакции 2NО2(г.)↔N2О4(г.) равна единице. В каком направлении сместится равновесие при температуре более низкой, чем найденная.
89. Найти температуру, при которой константа равновесия реакции 4НСl(г.)+О2(г.)↔2Н2О(г.) +2Сl2(г.) равна единице.
90. Стандартное изменение энергии Гиббса для реакции А+В↔АВ при 298 К равно –8 кДж\моль. Начальные концентрации веществ А и В равны 1 моль\л. Найти константу равновесия и концентрации веществ А, В и АВ.
 2018-01-21
2018-01-21 1532
1532








