Пример 1. Укажите в каком направлении повышается устойчивость карбонатов MgСО3(к); CaCО3(к); BaCO3(к).
Решение. Устойчивость веществ определяется значениями величин DН0образ (термическая устойчивость) и DG0образ (химическая устойчивость). Чем меньше эти значения, тем вещество более устойчиво. Для ответа сравним величины DН0образ и DG0образ данных карбонатов:
| Наименование карбоната | DН0образ, кДж/моль | DG0образ, кДж/моль |
| MgСО3 | -1096,21 | -1029,3 |
| CaСО3 | -1206 | -1128,8 |
| BaCO3 | -1202 | -1164,8 |
Из сравнения величин DG и DН следует, что устойчивость карбонатов в ряду MgСО3®CaCО3®BaCO3 повышается (термическая устойчивость CaCО3 и BaCO3 почти одинакова, т.к. 
Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе:
СН4(г)+СО2(г)Û2СО(г)+2Н2(г)
Решение. Для ответа на вопрос следует вычислить DG0298 прямой реакции (значения DG0298 соответствующих веществ приведены в табл.1 и в Приложении в табл.2). Зная, что DG0298 есть функция состояния и что DG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны 0, находим DG0298 процесса по формуле:
DG0х.р.=åDG0образ.пр.-åDG0образ.исх.
DG0х.р.=2(-137,27)+2(0)-(-50,79-394,38)=+170,63 кДж
То, что DG0298>0, указывает на невозможность самопроизвольного протекания прямой реакции при Т=298 К и равенстве давлений взятых газов 1,013×105 Па (760 мм рт.ст.=1 атм).
Таблица 1
| Вещество | Состояние | DG0298, кДж/моль | Вещество | Состояние | DG0298, кДж/моль |
| ВаСО3 | к | -1138,8 | FeO | к | -244,3 |
| СаСО3 | к | -1128,75 | H2O | ж | -237,19 |
| Fe3O4 | к | -1014,2 | H2O | г | -228,59 |
| ВеСО3 | к | -944,75 | PbO2 | к | -219,0 |
| СаО | к | -604,2 | CО | г | -137,27 |
| ВеО | к | -581,61 | CH4 | г | -50,79 |
| ВаО | к | -528,4 | NO2 | г | +51,84 |
| СО2 | г | -394,38 | NO | г | +86,69 |
| NaCl | к | -384,03 | C2H2 | г | +209,20 |
| ZnO | к | -318,2 |
Пример 3. Вычислите DН0, DS0, DG0Т реакции, протекающей по уравнению
Fe2O3(к)+3C=2Fe+3CO.
Возможна ли реакция восстановления Fe2O3 углеродом при температурах 500 и 1000 К?
Решение. DНх.р. и DSх.р. находим по формулам (DН, S – функции состояния систем):
DН0х.р.=åDН0прод.-åDG0исх.
DS0х.р.=åDS0прод.-åDS0исх.
DН0х.р.=[3(-110,52)+2×0]-[-822,10+3×0]=-331,56+822,10=+490,54 кДж/моль
DS0х.р.=(2×27,2+3×197,91)-(89,96+3×5,69)=541,1 Дж/моль
Энергию Гиббса при соответствующих температурах находим из соотношения
DG0Т=DН0-ТDS0:
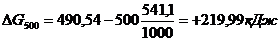
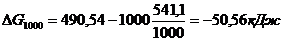
Так как DG500>0, а DG1000<0, то восстановление Fe2O3 углеродом возможно при 1000 К и не возможно при 500 К.
Пример 4. Реакция восстановления Fe2O3 водородом протекает по уравнению
Fe2O3 (к)+3Н2 (г)=2Fe (к)+3Н2О (г), DН=+96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS=0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fe2O3?
Решение. Вычисляем DG0 реакции:
DG0Т=DН0-ТDS0=96,61-298×0,1387=+55,28 кДж.
Так как DG0>0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG=0:
DН=ТDS; 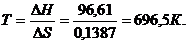
Следовательно, при температуре»696,5 К, начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Контрольные вопросы.
31. При сгорании 1 л ацетилена (н.у.) выделилось 56 кДж теплоты. Вычислите теплоту образования ацетилена С2Н2, DG0298.
32. Вычислите DН0, DS0, DG0500 реакции Fe2O3(к)+3Н2=2Fe(к)+3Н2О(г).
33. Реакция протекает по уравнению TiO2(к)+2С(к)=Ti(к)+2СО(г). Вычислите DН0, DS0, DG01000. Возможна ли эта реакция?
34.В ходе доменного процесса возможна реакция Fe3O4(к)+СО(г)=3FeO(к)+СО2(г). При какой температуре начнется эта реакция, если DН=+34,5 кДж?
35. Напишите термохимическое уравнение реакции взаимодействия газообразных аммиака и хлористого водорода. Сколько теплоты выделится в ходе этой реакции, если было израсходовано 100 л аммиака?
36. При гашении извести СаО водой выделяется 32,5 кДж теплоты. Напишите термохимическое уравнение реакции и определите энтальпию образования оксида кальция.
37. Предложите знак изменения энтропии в реакции СаО+СО2=СаСО3. Ответ подтвердите расчетом.
38. При сгорании 1 л водорода выделяется 12,76 кДж. Рассчитать энтальпию образования воды. Какая вода получается в результате этого процесса – пар или жидкость?
39. Ответьте, как влияет температура на вероятность осуществления процессов: а) разложение веществ
б) синтез веществ?
40. Оцените величины DН и DS реакции Fe2O3+3/2С(к)=3/2СО2(г)+2Fe(к). На их основании определите условия ее протекания.
41. Аллотропные модификации углерода. Теплота сгорания карбина ΔH0298 = 356,1 кДж/моль, а для графита теплота сгорания ΔH0298 = 396,3 кДж/моль. Сравнить термическую устойчивость графита и карбина. Чем объясняется необычное обилие соединений углерода.
42. Исходя из данных для реакций окисления мышьякового ангидрида кислородом и озоном: As2O3(к)+O2(г)=As2O5(к); DН01=-270,70 кДж,
3As2O3(к)+2O3(г)=3As2O5(к); DН02=-1095,79 кДж,
вычислите изменение энтальпии при переходе 1 моля кислорода в озон.
43.При сгорании 1 моля СН3СООН(ж) до СО2(г) и Н2О(ж) выделяется 871,69 кДж/моль. Вычислите энтальпию образования уксусной кислоты (DН0обр,298), если известно:
С(графит)+О2(г)=СО2(г); DН0298=-393,51 кДж/моль,
Н2(г)+1/2О2(г)=Н2О(ж); DН0298=-285,85 кДж/моль.
44. Пользуясь таблицами DG0обр,298 и S0обр,298, определите возможен ли самопроизвольный процесс Al2O3(к)+3SO3(ж)=Al 2 (SO4 )3 (к) при 298 К.
45. Пользуясь таблицами DG0обр,298 и S0обр,298, вычислите DG0298 и DS0298 реакции Zn(NO3)2(к)=ZnO(к)+2NO2(г)+1/2О2(г).
46. Пользуясь таблицами DG0обр,298 и DS0обр,298:а) вычислите DН0298 для реакции 4Fe(OH)2(тв)+О2(г)+2Н2О(ж)=4Fe(OH)3(тв), б) вычислите DН0298 Н2SО4(ж).
47. Пользуясь таблицами DG0обр,298, определите, могут ли происходить реакции: Н2О2(ж)+Ag2О(к)=2Ag(к)+О2(г)+Н2О(ж)
Cr(OH3)(к)+3J2(к)=CrO3(к)+2HJ(г).
48. Используя таблицы DG0обр,298 и DS0298, определите приближенное количество энергии, которое выделяется при сгорании 44,81 л диборана В2Н6, измеренного при н.у.
49. Какие выводы можно сделать относительно склонности к димеризации AlCl3? 2AlCl3(г)®Al2Cl6(г), если DG0298 образования AlCl3(г) и Al2Cl6(г) соответственно равны – 571,6 кДж/моль и 1219,2 кДж/моль.
50. Как изменяется термическая устойчивость гидроксидов элементов подгруппы Ве?
51. По таблицам DG0обр,298 и S0298, найдите DG0298, DН0298 и DS0298 для реакции разложения газообразного гидразина N2H4.
52. Сравните термическую устойчивость нитратов калия, свинца и серебра. Напишите уравнения реакций их термического разложения.
53. По таблицам DG0обр,298 и S0298, рассчитайте, какое количество теплоты выделится при разложении 1 г AgNО3?
54. Возможно ли при 250С течение процессов:
а) Hg(ж)+S(к, ромб)=HgS(к),
б) 2Hg(ж)+О2(г)=2НgO (к, красн)?
55. Какие из следующих реакций пригодны для синтеза HCN? Рассмотрите реакции как при 298 так и при 1000 К.
а) NH3(г)+СО(г)=HCN(г)+Н2О(г)
б) 1/2Н2(г)+С(графит)+1/2N2(г)=HCN(г)
56. Стандартные изобарные потенциалы HCl, HBr, HJ в водных растворах равны: -124,0 кДж/моль, -100,0 кДж/моль и -48,0 кДж/моль соответственно. Как изменится устойчивость кислот при переходе вниз по подгруппе?
57. Сравните изобарные потенциалы реакций:
MnO(к)+Н2О(ж)=Mn(ОН)2(ж) DG0298=-120 кДж/моль
Mn2O3(к)+3Н2О(ж)=2Mn(OH)3 DG0298=+76 кДж/моль.
Какой из оксидов MnO или Mn2O3 обладает более сильными основными свойствами.
58. Сравним стандартные теплоты реакции:
Na(к)+1/2F2=NaF(к) -544,0 кДж/моль
Na(к)+1/2Cl2(г)=NaCl(к) -400,0 кДж/моль
Na(к)+1/2Br2(г)=NaBr(к) -344,0 кДж/моль
Na(к)+1/2J2(г)=NaJ(к) -268,0 кДж/моль
Какой из галогенидов натрий наиболее устойчив?
59. Для получения серной кислоты используются следующие реакции:
DН0 DS0 DG0
S(к)+О2(г)=SO2(г) -70,9 2,7 -71,7
SO2(г)+1/2О2(г)=SO3(г) -23,7 -22,5 -17,0
SO3+Н2О(ж)=Н2SO4(ж) -35,4 -73,2 -32,5
Что Вы можете сказать об энергетической устойчивости SO2 и SO3.
60. При комнатной температуре олово может существовать в двух модификациях: серое олово и белой олово. Основываясь на термических характеристиках, данных в таблице
| Олово | DН0обр кДж/моль | S0 Дж/моль×К |
| Sn (белое) | ||
| Sn (серое) | -2 |
Определите, какое олово термически устойчиво при стандартной температуре.
Химическая кинетика – это учение о химическом процессе, его механизме и закономерности протекания во времени. При исследовании химических реакций применяют как методы химической термодинамики, так и методы химической кинетики. Химическая термодинамика позволяет вычислить тепловой эффект данной реакции, а также предсказать, осуществима ли данная реакция и состояние её равновесия, т.е. предел, до которого она может протекать. Но для практики нужно знать не только возможности осуществления данной реакции, но и скорость её протекания. Ответ на этот вопрос даёт химическая кинетика.
Химические реакции являются, как правило, сложными, т. е. протекают через ряд элементарных стадий. Элементарная стадия является наиболее простой составной частью сложной реакции: каждый акт элементарной стадии представляет собой результат непосредственного взаимодействия и превращения нескольких частиц. Совокупность реакции из элементарных стадий называется механизмом реакции. При протекании реакции по стадиям получаются и расходуются промежуточные вещества, которые обычно являются частицами с неспаренными электронами, так называемые радикалы.
Рассмотрим реакцию
Н2+I2=2HI
которая протекает через три последовательные элементарные стадии:
I2→2I·
I·+H2→HI+H·
2H·→H2
Скорости этих стадий различны. Стадия с наименьшей скоростью является лимитирующей и её скорость будет равна скорости общей реакции.
Скорость химической реакции – это изменение концентрации одного из реагирующих веществ в единицу времени в единице реакционного пространства.
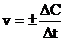 ,
,
где С – молярная концентрация одного из реагирующих веществ. Знак «+» относится к изменению концентрации вещества, образующегося в результате реакции, а знак «-», к изменению концентрации вещества, вступающего в реакцию.
Если реакция проходит в газовой смеси то концентрация С может быть заменена парциальным давлением какого-либо компонента смеси. Если реакция протекает на границе раздела фаз в гетерогенной системе, то выражение для скорости примет вид:
 ,
,
где S – площадь границы раздела фаз.
Скорость реакции зависит от природы реагирующих веществ, их концентрации, температуры и от присутствия в системе катализаторов. В тех случаях, когда для протекания реакции необходимо столкновение двух реагирующих частиц (атомов, молекул, радикалов), зависимость скорости реакции от концентрации определяется законом действия масс:
при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентрации реагирующих веществ.
Так, для реакции mА+nВ2→ … закон действия масс выражается следующим образом:
v = k [А]m[В2]n,
где [А], [В2] – молярные концентрации реагирующих веществ, а коэффициент k называется константой скорости химической реакции, который зависит от природы реагирующих веществ.
Если в реакции участвуют вещества в твёрдой фазе, то при записи закона действия масс их не нужно учитывать.
Пример 1. Как изменится скорость реакции
2NO(г.)+O2(г.)→2NO2(г.)
если уменьшить объём реакционного сосуда в 3 раза?
Решение. До изменения объёма скорость реакции выражалась уравнением
v = k [NO]2[O2]
Вследствие уменьшения объёма концентрация каждого из реагирующих веществ возросла в 3 раза. Следовательно, теперь
v1 = k (3[NO])2(3[O2])=27 k [NO]2[O2]
Сравнивая выражения для v и v1 видим, что скорость реакции возросла в 27 раз.
Ответ: скорость реакции возросла в 27 раз.
Зависимость константы скорости химической реакции выражается правилом Вант-Гоффа: скорость большинства химических реакций возрастает в 2-4 раза при повышении температуры на 100С. 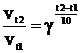 , где γ - температурный коэффициент скорости реакции.
, где γ - температурный коэффициент скорости реакции.
Пример 2. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастёт скорость реакции при повышении температуры от 20 до 75 0С?
Решение. Воспользовавшись правилом Вант-Гоффа получим:
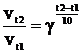 =2,85,5,
=2,85,5, 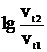 =5,5·lg2,8=2,458, отсюда vt2/vt1=287
=5,5·lg2,8=2,458, отсюда vt2/vt1=287
Ответ: в 287 раз.
Правило Вант-Гоффа приближённо выражает зависимость скорости реакции от температуры и носит эмпирический характер. Это связано с тем, что элементарный акт химической реакции протекает не при всяком столкновении реагирующих молекул: реагируют только те молекулы (активные молекулы), которые обладают достаточной энергией, чтобы разорвать или ослабить связи в исходных частицах. Поэтому каждая реакция характеризуется энергетическим барьером; для его преодоления необходима энергия активации – некоторая избыточная энергия (по сравнению со средней энергией молекул при данной температуре), которой должны обладать молекулы для того, чтобы их столкновение было эффективным. С ростом температуры число активных молекул быстро увеличивается, что и приводит к резкому возрастанию скорости реакции.
Зависимость константы скорости реакции от энергии активации выражается уравнением Аррениуса:
 ,
,
где Z-число столкновений молекул в секунду в единице объёма, Т-температура, R-универсальная газовая постоянная, Р-вероятность того, что столкновение двух молекул приведёт к образованию нового вещества.
Пример 3. Энергия активации некоторой реакции в отсутствие катализатора равна 75,24 кДж\моль, а с катализатором – 50,14 кДж\моль. Во сколько раз возрастёт скорость реакции в присутствии катализатора, если реакция протекает при 298 К.
Решение. Обозначим энергию активации реакции без катализатора через Εа, а с катализатором через Ε’а; соответствующие константы скорости реакции обозначим через k и k’. Используя уравнение Аррениуса находим:
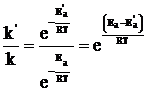 отсюда:
отсюда:

Подставляя данные задачи получим, что  , а значит
, а значит 
Ответ: скорость реакции возросла в 25 тысяч раз.
61. Во сколько раз изменится скорость реакции 2А+В→А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза?
62. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2(г.)+В2(г.) →2А2В(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась?
63. В 2 сосуда одной и той же вместимости помещены: в первый – 1 моль газа А и 2 моля газа В, во второй – 2 моля газа А и 1 моль газа В при одинаковой температуре. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением v1= k1 [А][В]; б) уравнением v2= k2 [А]2[В]?
64. Через некоторое время после начала реакции 3A+B→2C+D концентрации веществ составляли: [A]=0,03 моль/л; [B]=0,01 моль/л; [C]=0,008 моль/л. Каковы исходные концентрации веществ А и В?
65. Реакция между веществами А и В выражается уравнением: А+2В→С. Начальные концентрации составляют: [A]0=0,03 моль/л, [B]0=0,05 моль/л. Константа скорости реакции равна 0,4. Найти начальную скорость реакции и скорость реакции по истечении некоторого времени, когда концентрация вещества А уменьшится на 0,01 моль/л.
66. Как изменится скорость реакции 2NO(г.)+О2(г) →2NO(г.), если: а) увеличить давление в системе в 3 раза; б) уменьшить объём системы в 3 раза; в) повысить концентрацию NO в 3 раза?
67. Две реакции протекают при 25 0С с одинаковой скоростью. Температурный коэффициент скорости первой реакции равен 2, второй – 2,5. Найти отношение скоростей этих реакций при 95 0С.
68. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 градусов скорость реакции увеличивается в 15,6 раза?
69. Температурный коэффициент скорости некоторой реакции равен 2,3. Во сколько раз увеличится скорость реакции при повышении температуры на 25 градусов.
70. При 150 0С некоторая реакция заканчивается за 16 мин. Принимая температурный коэффициент скорости реакции равным 2,5, рассчитать, через какое время закончится эта реакция, если её проводить: а) при 80 0С; б) при 200 0С.
71. Во сколько раз увеличится скорость реакции, протекающей при 298 К, если её энергию активации уменьшить на 4 кДж/моль?
72. Чему равна энергия активации реакции, если при увеличении температуры от 290 до 300 К скорость её увеличится в 2 раза?
73. Каково значение энергии активации реакции, скорость которой про 300 К в 10 раз больше, чем при 280 К?
74. Энергия активации реакции равна 10 кДж/моль. Во сколько раз изменится скорость реакции при повышении температуры от 27 до 37 0С?
75. Рассчитайте энергию активации реакции, если при увеличении температуры от 500 до 1000К константа скорости химической реакции возросла в 105 раз.
 2018-01-21
2018-01-21 2857
2857








