Может принимать целочисленные значения в диапазоне от -l до +l (включая 0). Например:
Для l=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию.
Для l=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации.
Для l=2: m=-2;-1;0;+1;+2 - d-орбиталь имеет пять пространственных ориентаций.
Спиновое квантовое число ms
Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½.
Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу. Для частиц не очень высокой энергии, движущихся со скоростью  импульс равен
импульс равен 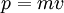 (где
(где  — масса частицы), и
— масса частицы), и  . Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость.
. Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость.
Уравне́ниеШрёдингера — уравнение, описывающее изменение в пространстве (в общем случае, в конфигурационном пространстве) и во времени чистого состояния, задаваемого волновой функцией, в гамильтоновых квантовых системах.

Атомная орбиталь — одноэлектронная волновая функция, полученная решением уравнения Шрёдингера для данного атома[1], задаётся главным n, орбитальным l имагнитным m квантовыми числами.
 2018-01-21
2018-01-21 824
824








