орбитальная энергия последовательно повышается по мере увеличения суммы  , причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа
, причём при одном и том же значении этой суммы относительно меньшей энергией обладает атомная орбиталь с меньшим значением главного квантового числа 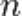 . Например, при
. Например, при 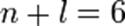 орбитальные энергии подчиняются последовательности
орбитальные энергии подчиняются последовательности 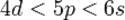 , так как здесь для
, так как здесь для 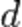 -орбитали главное квантовое число наименьшее
-орбитали главное квантовое число наименьшее  , для
, для 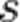 -орбитали
-орбитали  ; наибольшее
; наибольшее  ,
, 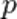 -орбиталь занимает промежуточное положение
-орбиталь занимает промежуточное положение  .
.
Или же:
При заполнении орбитальных оболочек атома более предпочтительны (более энергетически выгодны), и, значит, заполняются раньше те состояния, для которых сумма главного квантового числа 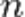 и побочного (орбитального) квантового числа
и побочного (орбитального) квантового числа 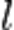 , т.е.
, т.е.  , имеет меньшее значение.
, имеет меньшее значение.
9) Периодический закон Д.И. Менделеева. Периодическая таблица (периоды и группы). Атомы бывают в основном, возбуждённом и валентном состоянии. Периодический закон –свойства элементов и веществ ими образуемых находятся в периодической зависимости от заряда ядер их атомов.
Группа – вертикальный ряд в таблице Менделеева, объединяющий общие по химическим и физическим свойствам элементы.
Период – горизонтальный ряд элементов, в пределах которого свойства элементов последовательно изменяются.
4 Группы элементов: s,p,d,f. Последними являются валентные s электроны.
Изменение свойств в таблице по периоду: слева на права радиус атома уменьшается, уменьшаются металлические и восстановительные свойства. Электроотрицательность, окислительные и неметаллические возрастают.
В группе(сверху вниз):радиус увеличивается, увеличиваются металлические и восстановительные свойства. Электроотрицательность уменьшается.
Химическая связь
Химическая связь – это взаимодействие, которое связывает отдельные атомы в молекулы, ионы, радикалы, кристаллы.
Энергия связи — это работа, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества.
Межъядерное расстояние между химически связанными атомами называется длиной химической связи.
Валентными углами - углами между линиями, соединяющими связываемые атомы.
Потенциал ионизации — энергия в эв (или в расчете на г атом в ккал), необходимая для отрыва одного или большего числа электронов от нейтрального атома и превращения его в положительно заряженный ион — катион.
Электроотрицательность — это способность атома притягивать к себе валентные электроны других атомов.
Сродство к электрону. Энергетический эффект присоединения электрона к нейтральному атому называется сродством к электрону (Е)
Э + е- = Э- - Е
Сродство к электрону выражается в кДж/моль или эВ/моль.
Для элементов главных подгрупп сродство к электрону возрастает в периодах слева направо и уменьшается в группах сверху вниз. Максимальное значение сродства к электрону имеет фтор.
Электроотрицательность. Способность атома, находясь в составе устойчивой молекулы, смещать к себе электронную плотность характеризуется электроотрицательностью.
Для s- и р-элементов электроотрицательность возрастает в периодах слева направо и уменьшается в группах сверху вниз. Минимальное значение сродства к электрону имеет франций, а максимальное – фтор.
 2018-01-21
2018-01-21 810
810








