Электроотрицательность- способность атома притягивать электроны.
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностью (>1,5 по шкале Полинга) электроотрицательностей, при которой общая электронная пара полностью переходит к атому с большей электроотрицательностью.(Электростатическое взаимодействие между ионами).
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1.7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
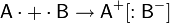
Ковалентная связь (атомная связь, гомеополярная связь) — это самая прочная, самая распространенная хим. связь образуется за счёт обобществления не спаренных электронов, атомов неметаллов в общую электронную пару (в орган.соед.).
A· + ·В → А: В
Между одинаковыми атомами – ковалентная неполярная(F2, H2, N2), между разными – ковалентная полярная(HCI, NaCI).
-Простая ковалентная связь. Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
|
|
|
H• + •H H: H
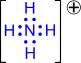
- Донорно-акцепторная связь. Для образования этого вида ковалентной связи оба электрона предоставляет один из атомов — донор. Второй из атомов, участвующий в образовании связи, называется акцептором. В образовавшейся молекуле формальный заряд донора увеличивается на единицу, а формальный заряд акцептора уменьшается на единицу.
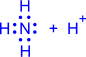 | |  |
- Семиполярная связь. Её можно рассматривать как полярную донорно-акцепторную связь. Этот вид ковалентной связи образуется между атомом, обладающим неподелённой парой электронов (азот, фосфор, сера, галогены и т. п.) и атомом с двумя неспаренными электронами (кислород, сера).
Координационная (Донорно-акцепторная) связь - частный случай ковалентной связи, при которой донор предоставляет целую электронную пару, акцептор- свободную арбиталь(NH4+, в комплексных соединениях [ ]).
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Водородная связь — электростатическое взаимодействие между положительно поляризованным атомом водорода и другим электроотрицательным атомом(O, S, N, F). Водородные связи могут быть межмолекулярными или внутримолекулярными. Особенностями водородной связи, по которым её выделяют в отдельный вид, является её не очень высокая прочность, её распространенность и важность, особенно в органических соединениях, а также некоторые побочные эффекты, связанные с малыми размерами и отсутствием дополнительных электронов у водорода.
|
|
|
12. Термодинамические системы: изолированные, закрытые, открытые, гомогенные, гетерогенные. Параметры системы.
Под термодинамической системой подразумевают избранную совокупность тел или веществ, состоящую из большого числа структурных единиц (молекул, атомов, ионов) и отделенную от окружающей внешней среды определенной границей или поверхностью раздела.
В зависимости от свойств поверхности раздела, термодинамические системы делятся на изолированные, закрытые и открытые.
Изолированные системы не могут обмениваться с окружающей средой ни веществом, ни энергией. Закрытые системы обмениваются с внешним миром только энергией, а открытые – и веществом, и энергией.
Если между отдельными частями системы не существует физических, т.е. реальных границ раздела, то такие системы называются гомогенными(однородными). Свойства данных систем, находящихся в состоянии равновесия, одинаковы во всех их точках.
Существуют также системы, между отдельными частями которых имеются границы раздела. При переходе через них многие свойства меняются скачкообразно. Такие системы называются гетерогенными.
Физические величины, характеризующие какое-либо свойство системы, называются термодинамическими параметрами. Они могут быть микроскопическими и макроскопическими.
Совокупность значений размеров и масс всех частиц (молекул либо ионов), составляющих систему, их положений в пространстве, скоростей движения и т.д. называется набором микроскопических параметров.
Величины, характеризующие всю систему в целом (давление, объем, температура, масса, плотность и т.д.) называются макроскопическими параметрами.
Некоторые макроскопические параметры системы (масса, внутренняя энергия) могут быть заданы как сумма соответствующих микроскопических параметров.
Экстенсивными называются такие параметры, значения которых для всей системы равны сумме значений этих же параметров для отдельных частей системы (например, масса, объем).
Совокупность численных значений термодинамических параметров системы, характеризующих ее физические и химические свойства (присущие ей в данный момент времени), называется иначе состоянием системы.
Если значения параметров не меняются во времени, такое состояние системы называется равновесным. Такое состояние называется стационарным.
Изменение во времени значений одного или нескольких макроскопических параметров системы называют иначе термодинамическим процессом.
Сумму всех процессов, которые вывели систему из начального состояния, а затем вернули ее в это же состояние, называют круговым процессом или циклом.
Все процессы, встречающиеся в природе, можно разделить на самопроизвольные и несамопроизвольные.
Термодинамические процессы подразделяются также на обратимые и необратимые, равновесные и неравновесные.
Процесс называется термодинамически обратимым, если его можно провести и в прямом, и в обратном направлении.
Реальные процессы, протекающие в природе, являются термодинамически необратимыми и неравновесными.
Функции состояния системы: внутренняя энергия, энтальпия, энтропия, химический потенциал, изобарно- и изохорно-изотермический потенциал. Изобарные, изохорные, изотермические процессы.
Энергетическое состояние химической реакции как системы описывается с использованием следующих характеристик: U-внутренняя энергия,H-энтальпия,S-энтропия,G-энергия Гиббса.Теплота, которую получает система, идет на приращение внутренней энергии и совершение работы: Q=DU+A. Если система не совершает никакой работы, кроме работы расширения, тоQ=DU+pDV. ВеличинаDH=DU+pDVприp=constназывается энтальпией реакции. Т.к. внутреннюю энергию тела измерить невозможно (можно измерить только изменениеDU), то точно так же невозможно измерить энтальпию тела – в расчетах используется изменение энтальпииDH.
|
|
|
Законы термохимии:
Лавуазье-Лапласа: тепловой эффект образования химических соединений равен, но обратен по знаку тепловому эффекту его разложения.
Гесса: тепловой эффект реакции при постоянном давлении или объеме зависит только от начального и конечного состояния системы и не зависит от пути перехода.
Энтропия – количественная мера беспорядка системы. Энтропия зависит от: от числа частиц в системе, от природы вещества, от агрегатного состояния. Для газообразных веществ знак DS определяется по изменению объема. Если объем не изменяется, то знак определить нельзя. В изолированных системах возможны процессы, которые идут с увеличением энтропии. Это означает, что знак DS можно принять за критерий возможного самопроизвольного протекании реакции (только в изолированных системах!).
Химическийпотенциал 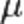 — термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц.Для систем с переменным составом и для любого типа реакцийåmini=0 – условие химического равновесия,m-энергия Гиббса 1 моля вещества (для однокомпонентной системы). Значение химического потенциала нельзя измерить, но можно рассчитать исходя из уравнения связывающего химический потенциал с составом:mi=mio+RTlnK, гдеK={Pi-парциальное давление,Ci-концентрация,Cmi-массовая доля,Xi-мольная доля} – константа. Для реальных растворов - mi=mio+RTlnAi.
— термодинамическая функция, применяемая при описании состояния систем с переменным числом частиц.Для систем с переменным составом и для любого типа реакцийåmini=0 – условие химического равновесия,m-энергия Гиббса 1 моля вещества (для однокомпонентной системы). Значение химического потенциала нельзя измерить, но можно рассчитать исходя из уравнения связывающего химический потенциал с составом:mi=mio+RTlnK, гдеK={Pi-парциальное давление,Ci-концентрация,Cmi-массовая доля,Xi-мольная доля} – константа. Для реальных растворов - mi=mio+RTlnAi.
Суммарное влияние энергетических и энтропийных факторов при постоянном давлении и температуре отражает изменение изотермического потенциала, который называется изменением свободной энергии Гиббса: DG=DH-TDS. Свободной энергией Гиббса называется энергия, складываемая из энергий химических связей. Знак DG есть критерий термодинамической вероятности самопроизвольного протекания процесса в данных условиях (p,T=const). При данных условиях могут самопроизвольно протекать только те процессыDG для которых меньше 0. При низких температурах протекают главным образом экзотермические реакции. При высоких температурах главную роль играет энтропийный член уравнения.
|
|
|
ИЗОХОРНО-ИЗОТЕРМИЧЕСКИЙ ПОТЕНЦИАЛ - свободная энергия, энергияГельмгольца, - один из потенциалов термодинамических, равный F = U - TS, где U, S и Т - внутренняя энергия, энтропия и термодинамическая температура системы. При изотермическом переходе (T=const) системы из состояния 1, в котором её изохорно-изотермический потенциал равен F 1, в состояние 2, в котором её изохорно-изотермический потенциал равен F2, система совершает работу А < (F1 - F2), где знак равенства соответствует обратимому процессу, а знак неравенства - необратимому процессу. То есть, изменение изохорно-изотермического потенциала определяет работу, совершаемую системой в обратимом изотермическом процессе.
ИЗОБАРНО-ИЗОТЕРМИЧЕСКИЙ ПОТЕНЦИАЛ Гиббса- энергия, свободная энтальпия, - один из потенциалов термодинамических, равный
G = Н - TS, где Н, S, Т - энтальпия,
энтропия, термодинамическая температура системы. Изобарно-изотермический потенциал пропорционален числу частиц в системе; отнесённый к одной частице он называется химическим потенциалом. Изобарно-изотермический потенциал удобен для описания процессов, в которых возможен обмен веществом с окружающими телами.
Изобарный процесс — процесс изменения состояния термодинамической системы при постоянном давлении ().
Изохорный процесс — процесс изменения состояния термодинамической системы при постоянном объёме ().
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре ()
 2018-01-21
2018-01-21 5343
5343
