Некоторые характеристики атома и свойства элементов:Периодичность накопления электронов около ядра приводит к периодичности в изменении свойств атомов элементов. Периодически изменяются такие характеристики атомов, как валентность, объемы атомов, радиусы атомов и ионов, энергии ионизации, восстановительные свойства, энергии сродства к электрону, окислительные свойства, электроотрицательности, некоторые физические свойства (температуры плавления и кипения и др.).Понятие валентность более подробно рассмотрим позже.Перейдем к рассмотрению других характеристик.
1. Изменения свойств химических элементов и их соединений в группах:
В группах все элементы имеют сходное электронное строение. Различий в наполнении внешнего энергетического уровня электронами нет.
Меняется размер атома - сверху вниз в группе радиусы атомов увеличиваются!
Что это означает? Это означает, что
1) внешние электроны все слабее притягиваются к ядру атома;
2) возрастает способность атома отдавать электроны.
3) способность отдавать электроны=металлические свойства, т.е.
В группах сверху вниз возрастают металлические свойства элементов
усиливаются основные свойства их соединений
Изменения химических свойств элементов и их соединений в периодах:
В периодах наблюдается несколько другая картина:
1) Слева направо в периодах радиусы атомов уменьшаются;
2) количество электронов на внешнем слое при этом увеличивается;
3) электроотрицательностьэлементов = неметаллические свойства увеличивается
В периодах слева направо возрастают неметаллические свойства элементов, электроотрицательность;усиливаются кислотные свойства их соединений. Исходя из этих соображений получается, что звание «Король Неметаллов» у нас присуждается… (барабанная дробь)… F! Рядом с ним даже кислород (O) проявляет положительную степень окисления: OF2 — бесцветный ядовитый газ с неприятным запахом.Итак, подведем итог:С увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне. Есть еще элементы, которые образуют так называемые амфотерные соединения. Они проявляют как металлические, так и неметаллические свойства.К ним относятся:Zn,Cr,Al,Sn,Pb,Mn,Fe,Be.
воп10 метод валентных связейМетод валентной связи. Метод валентной связи (МВС) дает теоретическое объяснение важнейших свойств ковалентной связи, позволяет понять строение большого числа молекул. В основе МВС лежат следующие положения: 1. Ковалентная химическая связь образуется двумя электронами с противоположно направленными спинами, причем эта электронная пара принадлежит двум атомам. Комбинации таких двухэлектронныхдвухцентровых связей, отражающие электронную структуру молекулы, получили название валентных схем. 2. Ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Для наглядного изображения валентных схем обычно пользуются следующим способом. Электроны, находящиеся во внешнем электронном слое, обозначаются точками, располагаемыми вокруг химического символа атома. Общие для двух атомов электроны показывают точками, помещаемыми между их химическими символами; двойная или тройная
Метод валентных связей
Основные принципы образования химической связи по МВС:
1. Химическая связь образуется за счет валентных (неспаренных) электронов.
2. Электроны с антипараллельными спинами, принадлежащие двум различным атомам, становятся общими.
3. Химическая связь образуется только в том случае, если при сближении двух и более атомов полная энергия системы понижается.
4. Основные силы, действующие в молекуле, имеют электрическое, кулоновское происхождение.
5. Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.Существует два механизма образования ковалентной связи. Обменный механизм. Связь образована путем обобществления валентных электронов двух нейтральных атомов. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
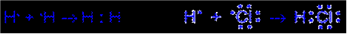
Рис. 7. Обменный механизм образования ковалентной связи: а – неполярной; б – полярной
Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь.Соединения, образованные по донорно-акцепторному механизму, относятся к комплексным соединениям

Теория валентных связей заложена в 1927 году В.Гайтлером и Ф.Лондоном на примере квантовохимического расчёта молекулы водорода. В основе теории валентных связей лежит гипотеза о том, что при образовании молекулы из атомов, последние в значительной мере сохраняют свою электронную конфигурацию, а связывание атомов достигается в результате обмена электронов между ними и спаривания спинов двух электронов, находящихся на атомных орбиталях исходных атомов. Расчёт Гайтлера — Лондона оказался весьма значительным по своим результатам в развитии квантовой химии. В подтверждение электронной октетной теории (правило октета) Г.Льюиса было показано, что химическая связь в молекуле водорода действительно осуществляется парой электронов.Электронная пара оказывается размазанной по всему пространству молекулы с различной плотностью, причём на линии связи между ядрами имеется сгущение электронной плотности по сравнению с другими областями пространства. Это сгущение электронной плотности на линии, связывающей ядра атомов, вызывает стягивающее действие на ядра и, соответственно, приводит к образованию химической связи (рис.1). Энергия связи определяется в основном обменным интегралом, величина которого существенно зависит от степени перекрывания атомных орбиталей атомов
 2018-01-21
2018-01-21 634
634








