Второй закон Рауля.Тот факт, что давление паров над раствором отличается от давления паров над чистым растворителем, существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля. Понижение температуры кристаллизации растворов Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенствовсегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора. 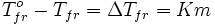 Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур. Повышение температуры кипения растворов. Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b. Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур. Повышение температуры кипения растворов. Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b. Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора 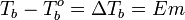
32.Осмотическое давление.Закон Вант-Гоффа. Процесс самопроизвольного перехода растворителя (диффузия) через полупроницаемую мембрану, называемый осмосом.Давление, которое необходимо приложить к раствору, чтобы осмос прекратился, называется осмотическим давлением. Если давление, приложенное к более концентрированному раствору, больше осмотического, то растворитель будет переходить из раствора в растворитель. Процесс носит название обратный осмос и используется для очистки природных и сточных вод, в частности, может быть использован для водоподготовки в теплоэнергетике.Зависимость осмотического давления от температуры и концентрации описывается уравнением π = с(В)RT, где π – осмотическое давление; с(В) – молярная концентрация растворенного вещества, моль/л; R – универсальная газовая постоянная; T – температура, К. Закон Вант-Гоффа: осмотическое давление равно тому давлению, которое оказывало бы растворенное вещество, если бы оно, находясь в газообразном состоянии при той же температуре, занимало тот же объем, который занимает раствор.Из закона Вант-Гоффа следует, что растворы различных неэлектролитов одинаковой концентрации, находящиеся при одинаковой температуре являются изотоническими, т.е. имеющими одинаковое осмотическое давлениеУравнение, которое описывает это правило, следующее:
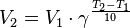 где
где 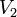 — скорость реакции при температуре
— скорость реакции при температуре 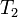 ,
, 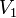 — скорость реакции при температуре
— скорость реакции при температуре 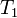 ,
, 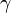 — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
— температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов).
33.Электролиты. Электролитическая диссоциация. Степень и константа диссоциации, связь между ними.Электролиты – это вещества, которые проводят эл. ток если они находятся в растворенном или расплавленном состояниях. Носителями электричества в растворе являются анионы(-), катионы(+). При растворении солей, кислот, оснований в воде происходит диссоциация этих веществ с образованием эл. заряженных частиц катионов и анионов. Эл проводимость водных растворов пропорционально общей концентрации ионов в растворе. i - изотонический коэффициент – показывает, во сколько раз осмотическое давление данного раствора больше нормального.∆Ткип=i * KE*CmАррениус ввел понятие степень электролитической диссоциации α – это отношение числа продиссоциирующих молекул на ионы к общему числу молекул. α = (i-1)/(k-1) k – это число от2 до 4 электролитическая диссоциация вызывается взаимодействием полярных молекул растворителя с частицами растворимого вещества. Это взаимодействие приводит к поляризации связей и происходит образование ионов за счет ослабления и разрыва связей в молекулах растворяемого вещества. электролиты: а) сильные - 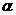 = 1: сильные кислоты,сильные основания, все соли – вещества которые при растворении в воде практически полностью распадаются на ионы HCl, HBr, HNO3.. б) слабые -
= 1: сильные кислоты,сильные основания, все соли – вещества которые при растворении в воде практически полностью распадаются на ионы HCl, HBr, HNO3.. б) слабые - 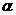 < 1: слабые кислоты, слабые основания, вода – вещества, частично диссоциирующие на ионы. Константа диссоциации является важной характеристикой слабых электролитов так как указывает на прочность их молекул в данном растворе (для сильных электролитов константы диссоциации отсутствуют). Связь между степенью и константой диссоциации показывает закон разбавления Оствальда (1888 г.)Закон разбавления Освальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается
< 1: слабые кислоты, слабые основания, вода – вещества, частично диссоциирующие на ионы. Константа диссоциации является важной характеристикой слабых электролитов так как указывает на прочность их молекул в данном растворе (для сильных электролитов константы диссоциации отсутствуют). Связь между степенью и константой диссоциации показывает закон разбавления Оствальда (1888 г.)Закон разбавления Освальда: с уменьшением концентрации раствора степень диссоциации слабого электролита увеличивается 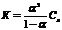
34.Свойства растворов электролитов. Изотонический коэффициент, его определение. Связь изотонического коэффициента со степенью диссоциации. Степень диссоциации — величина, характеризующая состояние равновесия в реакции диссоциации в гомогенных системах. Степень диссоциации α равна отношению числа диссоциированных молекул n к сумме n + N, где N — число недиссоциированных молекул. Часто α выражают в процентах. Переносчиками электрического тока в растворах электролитов являются ионы, образующиеся при диссоциации молекул электролитов. Поскольку при диссоциации число частиц в растворе возрастает, растворы электролитов обладают аномальными коллигативными свойствами. Уравнения, описывающие коллигативные свойства неэлектролитов, можно применить и для описания свойств идеальных растворов электролитов, если ввести поправочный, Изотонический коэффициент (также фактор Вант-Гоффа; обозначается i) — безразмерный параметр, характеризующий поведение вещества в растворе. Он численно равен отношению значения некоторого коллигативного свойства раствора данного вещества и значения того же коллигативного свойства неэлектролита той же концентрации при неизменных прочих параметрах системы,например: осм. = iCRT или Tзам. = iKm. Изотонический коэффициент связан со степенью диссоциации электролита: i = 1 + (n - 1), где n - количество ионов, образующихся при диссоциации одной молекулы. Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона ai выражается в виде произведения концентрации иона mi на его коэффициент активности i:ai = i mi. изотонический коэффициент показывает, насколько в растворе электролита больше частиц по сравнению с раствором неэлектролита аналогичной концентрации, и связан со способностью вещества распадаться в растворе на ионы, то есть, со степенью диссоциации. Изотонический коэффициент показывает во сколько раз реальное число частиц растворенного вещества больше чем теоретически ожидаемое (если предполагать, что вещество в растворе присутствует только в виде молекул).
Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:1. Электролиты в растворах распадаются на ионы – диссоциируют;2. Диссоциация является обратимым равновесным процессом;3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул N: 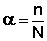 Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
35.Произведение растворимости. Электролитическая диссоциации воды. Ионное произведение воды. Ионное произведение воды. рН раствора. Значение константы диссоциации воды КН2О = 1·10–14. Данную константу для воды называют ионным произведением воды, которое зависит только от температуры.Согласно реакции Н2О Н+ + ОН–, при диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–] = 10–7.рН = –lg[Н+]Водные растворы имеют значение рН в интервале от 1 до 14. По соотношению концентраций этих ионов различают три типа сред: нейтральную, кислую и щелочную.Нейтральная среда – среда, в которой концентрации ионов [Н+] = [ОН–] = 10–7 моль/л (рН = 7).Кислая среда – среда, в которой концентрация ионов [Н+] больше концентрации ионов [ОН–], т.е. [Н+] > 10–7 моль/л (рН < 7). Щелочная среда–среда, в которой концентрация ионов [Н+] меньше концентрации ионов [ОН–], т.е. [Н+] < 10–7 моль/л (рН > 7).Качественно реакцию среды и рН водных растворов электролитов определяют при помощи индикаторов и рН-метра.Например, если концентрация ионов [H+] = 10–4 моль/л, то рН = – lg10–4 = 4 и среда раствора кислая, а если концентрация ионов [ОН–] = 10–4 моль/л, то [Н+] = К(Н2O) – [ОН–] = 10–14 – 10–4 = 10–10, а рН = – lg10–10 = 10 и среда раствора щелочная. в насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре. Эта величина количественно характеризует способность электролита растворяться; ее называют произведением растворимости ПРAmBn= [A]m∙ [B]n Очищенная от посторонних примесей вода обладает незначительной электропроводностью, заметно возрастающей с повыщением тем-ры.H2O является слабым электролитом (H2OÛH+ +OH—). 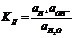 Концентрацию молекул воды можно расчитать,разделив массу 1л воды на массу ее моля: 1000/18=55.5 моль/л. Считая эту величину постоянной, можно записать СН+ СОН—=КД55,5=Кw.Константу равновесия Кw наз ионным произведением воды. Она сильно зависит от температуры.Равновесие электролитической диссоциации воды влияет на общее равновесие в среде электролита, содержащего те или другие растворенные вещества. Согласно уравнению электролитической диссоциации воды, вода является типичным амфотерным соединением, так как при ее диссоциации образуются ионы водорода - носители кислотных свойств и ионы гидроксила - носители щелочных свойств. В отличие от других электролитов степень электролитической диссоциации воды при повышении температуры значительно возрастает В результате гидролиза смещается равновесие электролитической диссоциации воды.
Концентрацию молекул воды можно расчитать,разделив массу 1л воды на массу ее моля: 1000/18=55.5 моль/л. Считая эту величину постоянной, можно записать СН+ СОН—=КД55,5=Кw.Константу равновесия Кw наз ионным произведением воды. Она сильно зависит от температуры.Равновесие электролитической диссоциации воды влияет на общее равновесие в среде электролита, содержащего те или другие растворенные вещества. Согласно уравнению электролитической диссоциации воды, вода является типичным амфотерным соединением, так как при ее диссоциации образуются ионы водорода - носители кислотных свойств и ионы гидроксила - носители щелочных свойств. В отличие от других электролитов степень электролитической диссоциации воды при повышении температуры значительно возрастает В результате гидролиза смещается равновесие электролитической диссоциации воды.
36.Водородный показатель. Методы определения концентрации ионов водорода. Водоро́дный показа́тель, pH (лат. pondus Hydrogenii - сила водорода, произносится «пэ аш»— мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на один литр: 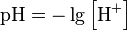 Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.1Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.2Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.3Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.4Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.5Влияние температуры на значения pH0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3 0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-основного титрования.1Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в основной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1–2 единицы.2Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислой области в щелочную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.3Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H+ в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.4Аналитический объёмный метод — кислотно-основное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.5Влияние температуры на значения pH0,001 моль/Л HCl при 20 °C имеет pH=3, при 30 °C pH=3 0,001 моль/Л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
37.Гидролиз солей. Степень гидролиза. Примеры гидролиза солей.Гидролиз солей - это химическое взаимодействие ионов соли с ионами воды, приводящее к образованию слабого электролита. Степень гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кгид, тем необратимее гидролиз. Кгид имеет свое выражение для каждого случая гидролиза.Соль образована сильным основанием и слабой кислотой (на примере NaCNS).
Сокращенное уравнение гидролиза: CNS- + HOH <=> HCNS + OH- Крав = Кгид = [HCNS] [OH-] * [H+] [CNS-] [HOH] * [H+]В этом выражении для Крав числитель и знаменатель дроби умножили на [H+]. Очевидно, что выражение для Кгид принимает вид: Кгид = К-w / Кдис (HCNS). Поскольку К-w величина постоянная и равна 10-14, очевидно, что чем меньше Кдис слабой кислоты, анион которой входит в состав соли, тем больше Кгид.Соль образована слабым основанием и сильной кислотой (на примере NH4CI)Сокращенное уравнение гидролиза: NH4+ + HOH <=> NH4OH + H+Крав = Кгид = [NH4OH]* [H+] * [OH-] / [H+] * [HOH] * [OH-],В этом выражении для Крав числитель и знаменатель дроби умножили на [OH-], поэтому выражение для Кгид принимает вид: Кгид = К-w / Кдис (NH4OH).Очевидно, что чем меньше Кдис слабого основания, катион которого входит в состав соли, тем больше Кгид.Соль образована слабым основанием и слабой кислотой (на примере NH4CNS). Сокращенное уравнение гидролиза: NH4+ + CNS- + HOH <=> NH4OH + HCNS Крав = Кгид = [NH4OH]* [HCNS]* [OH-]* [H+] / [NH4+]*[CNS-]*[HOH]*[OH-]*[H+], В этом выражении для Крав числитель и знаменатель дроби умножили на [H+]*[OH-], поэтому выражение для Кгид принимает вид: Кгид = К-w / Кдис (NH4OH) * Кдис (HCNS). Между Кгид и άгид соли существует связь, которая выражается уравнением закона Оствальда.άгид = (Кгид / СМ соли)1/2.Концентрацию ионов OH- или H+, которые накапливаются в растворе при гидролизе солей, а также рОН и рН можно рассчитать по следующим формулам. а) для соли образованной сильным основанием и слабой кислотой: [OH-] = άгид * СМ соли Тогда рН = 14 – рОН = 14 – Ig(άгид * СМ соли) или рН = 14 – lg [(Кw / Кдис слаб..кисл. * СМ соли)1/2]б) для соли образованной слабым основанием и сильной кислотой [H+] = άгид * СМ соли.Тогда рН = – Ig[H+] = -Ig(άгид * СМ соли) или рН = – lg [(Кw / Кдис слаб.основ. * СМ соли)1/2]
38.Окислительно-восстановительные процессы. Классификация окислительно-восстановительных реакций. Метод электронного баланса. Окислительно-восстановительными (или редокc-реакциями) называются реакции, сопровождающиеся переносом электронов от донора к акцептору (1). По аналогии с кислотно-основными реакциями) взаимодействующие вещества образуют сопряженные пары, которые принято называть окислительно-восстановительными парами (редокс-парами от англ, Redoxpara, Redoxsystem, 2). Оба компонента редокс-пары различаются числом электронов. Богатый электронами компонент называется восстановленной формой, а бедный электронами - окисленной формой соответствующего соединения. В ходе редокс-реакции восстановленная форма одной редокс-пары (восстановитель) переносит электроны на окисленную форму (окислитель) другой пары. При этом восстановитель окисляется, а окислитель восстанавливается (3). Любой восстановитель эффективен лишь в определенных реакциях. На основании таких наблюдений можно построить окислительно-восстановительный ряд (4).
Источник: http://www.xumuk.ru/biochem/38.html
Окисли́тельно-восстанови́тельные реа́кции, также редокс (англ. redox, от reduction-oxidation — окисление-восстановление) — это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:
Н2S + Cl2 → S + 2HCl
Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:
2H2O → 2H2 + O2
Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl
Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например:
NH4NO3 → N2O + 2H2O
Метод электронного баланса — один из методов уравнивания окислительно-восстановительных реакций (ОВР).Заключается в том чтобы на основании степеней окисления расставить коэффициенты в ОВР.Для правильного уравнивания следует придерживаться определённой последовательности действий:
Найти окислитель и восстановитель.
Составить для них схемы (полуреакции) переходов электронов, отвечающие данному окислительно-восстановительному процессу.
Уравнять число отданных и принятых электронов в полуреакциях.
Просуммировать порознь левые и правые части полуреакций.
Расставить коэффициенты в уравнении окислительно восстановительной реакции.
1. 39.Электродные потенциалы. Механизм их возникновения. Двойной электрический слой. Уравнение Нернста. Ряд напряжений. Дописать формулу Нернста ниже!
Электро́дный потенциа́л — разность электрических потенциалов между электродом и находящимся с ним в контакте электролитом (чаще всего между металлом и раствором электролита).
Возникновение электродного потенциала обусловлено переносом заряженных частиц через границу раздела фаз, специфической адсорбцией ионов, а при наличии полярных молекул (в том числе молекул растворителя) — ориентационной адсорбцией их. Величина электродного потенциала в неравновесном состоянии зависит как от природы и состава контактирующих фаз, так и от кинетических закономерностей электродных реакций на границе раздела фаз.
Равновесное значение скачка потенциалов на границе раздела электрод/раствор определяется исключительно особенностями электродной реакции и не зависит от природы электрода и адсорбции на нём поверхностно-активных веществ. Эту абсолютную разность потенциалов между точками, находящимися в двух разных фазах, нельзя измерить экспериментально или рассчитать теоретически.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами. Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.Вывод уравнения Нернста.Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон. Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия, когда известны давление и температура. Таким образом, этот закон связывает термодинамику с электрохимической теорией в области решения проблем, касающихся сильно разбавленных растворов. ,дописать формулу.
где
— электродный потенциал, — стандартный электродный потенциал, измеряется в вольтах;
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
— число молей электронов, участвующих в процессе;
и — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант и и перейти от натуральных логарифмов к десятичным, то при получим
Электрохимический ряд напряжений, последовательность расположения электродов в порядке возрастания их стандартных электродных потенциалов.
Металлические электроды в водном растворе электролита образуют следующий электрохимический ряд напряжений: Li, К, Rb, Ba, Sr, Ca, Na, Се, Mg, Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au. Для сравнения включены водородный электрод (Pt, H2[l атм] | Н+), потенциал которого при давлении водорода 1,01 x 105 Па и термодинамической активности а ионов Н+ в водном растворе, равной 1, при всех температурах принимается равным нулю (потенциалопределяющая реакция Н+ + е 1/2Н2, где е - электрон) и кислородный электрод (потенциалопределяющая реакция О2 + 2Н2О + 4е 4ОН-).
Электрохимический ряд напряжений позволяет судить о термодинамической возможности протекания тех или иных электродных процессов. Металл с более отрицательным потенциалом может вытеснять металл с менее отрицательным потенциалом из растворов его солей, растворяясь при этом. Металлы, имеющие отрицательный стандартный потенциал по сравнению с водородным электродом (так называемые электроотрицательные металлы), в растворах с не слишком большой термодинамической активностью ионов металла имеют более отрицательный потенциал, чем водородный электрод в сильнокислых растворах. Поэтому при замыкании такого электрода с водородным между ними протекает ток, металл растворяется, а на водородном электроде выделяется водород.
 2018-01-21
2018-01-21 3463
3463
