Правило Вант-Гоффа. Скорость химической реакции зависит от температуры, причем при повышении температуры скорость реакции увеличивается. Голландский ученый Якоб Вант-Гофф показал, что при повышении температуры на десять градусов скорость большинства реакций увеличивается в 2—4 раза 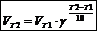 где VT1и VT2скорости реакции при температурах T2 и T1; g=VT2/VT1— температурный коэффициент скорости реакции,показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 K.
где VT1и VT2скорости реакции при температурах T2 и T1; g=VT2/VT1— температурный коэффициент скорости реакции,показывает, во сколько раз увеличивается скорость реакции при повышении температуры на 10 K.
Энергия активации Еа-один из основных параметров, который характеризует скорость хим. взаимодействия, равна той min энергии кот.необходимо сообщить частицам реаг. веществ чтобы они при столкновении могли вступить в хим. взаимодействие, кот. возможно лишь в случаи если будут преодолены силы отталкивания эл. оболочек. Еа<40кДж/моль – реакция быстрая, Еа>120-медленная. Энергия активации необходима в основном для ослабления хим. связей в исходных веществах и для преодоления отталкивания между эл., кот.возникает при сближении молекул и атомов взаим. веществ и мешает их столкновению.Молекулы, обладающие такой энергией, называются активными молекулами. Энтропия активации Sa- учитывает вероятность благоприятной ориентации соударяющихся молекул, т.е. вероятность их столкновения активными участками.. Температуратурнаязав.скорреак.. При повышении температуры на каждые 10ºC скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:Vt2 / Vt1= g(t2 - t1) / 10(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; g- температурный коэффициент данной реакции).Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:k = A ∙ e -Ea/RTгде: A - постоянная, зависящая от природы реагирующих веществ;R - универсальная газовая постоянная [8,314 Дж/(моль ∙ К) = 0,082 л ∙ ═атм/(моль∙К)];Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.Энергетическая диаграмма химической реакции.
|
|
|

 1 рис-Экзотермическая реакция 2-Эндотермическая реакцияА - реагенты, В - активированный комплекс (переходное состояние), С - продукты.Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры. Активированныйкомплекс. Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или с ослабле-ния связей между атомами в молекулах ис-ходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации
1 рис-Экзотермическая реакция 2-Эндотермическая реакцияА - реагенты, В - активированный комплекс (переходное состояние), С - продукты.Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры. Активированныйкомплекс. Реакции, требующие для своего протекания заметной энергии активации, начинаются с разрыва или с ослабле-ния связей между атомами в молекулах ис-ходных веществ. При этом вещества переходят в неустойчивое промежуточное состояние, характеризующееся большим запасом энергии. Это состояние называется активированным комплексом или переходным состоянием. Именно для его образования и необходима энергия активации
 2018-01-21
2018-01-21 1647
1647
