В приведенной таблице есть данные:

Эту константу называют ионным произведением воды, которое зависит только от температуры. Согласно диссоциации на 1 ион Н+ приходится один гидроксид-ион. В чистой воде концентрация этих ионов одинакова: [ H+] = [ OH-].
Отсюда, [ H+ ] = [ OH -] =  = 10-7 моль/л.
= 10-7 моль/л.
Если добавить в воду постороннее вещество, например, хлороводородную кислоту, то концентрация ионов водорода возрастет, но ионное произведение воды от концентрации не зависит.
А если добавить щелочь, то повысится концентрация [OH-] ионов, а количество водорода понизится.
Концентрация [H+] и [OH-] взаимосвязаны: чем больше одна величина, тем меньше другая.
Кислотность раствора (рН).
Кислотность растворов обычно выражается концентрацией ионов Н+. В кислых средах рН <10-7 моль/л, в нейтральных - рН = 10-7моль/л, в щелочных – рН > 10-7 моль/л.
Кислотность раствора выражают через отрицательный логарифм концентрации ионов водорода, называя ее рН.
рН = -lg[H+].
Взаимосвязь между константой и степенью диссоциации.
Рассмотрим пример диссоциации уксусной кислоты:

Найдем константу:

Молярная концентрация С=1/V, подставим в уравнение и получим:

Эти уравнения являются законом разведения В. Оствальда, согласно которому константа диссоциации электролита не зависит от разведения растовра.
Вопрос
Буферные системы, буферные растворы, буферные смеси, системы, поддерживающие определённуюконцентрацию ионов водорода Н+, то есть определённую кислотность среды. Кислотность буферных растворов почти не изменяется при их разбавлении или при добавлении к ним некоторых количеств кислот или оснований.

|
Примером буферной системы служит смесь растворов уксусной кислоты CH3COOH и её натриевой солиCH3COONa. Эта соль как сильный электролит диссоциирует практически нацело, т. е. даёт много ионов CH3COO-. При добавлении к буферной системе сильной кислоты, дающей много ионов Н+, эти ионы связываются ионамиCH3COO- и образуют слабую (то есть мало диссоциирующую) уксусную кислоту:
Наоборот, при подщелачивании буферной системы, то есть при добавлении сильного основания (например, NaOH),ионы OH- связываются Н+-ионами, имеющимися в буферной системе благодаря диссоциации уксусной кислоты; при этом образуется очень слабый электролит — вода:

|
По мере расходования Н+-ионов на связывание ионов OH- диссоциируют всё новые и новые молекулы CH3COOH, так что равновесие (1) смещается влево. В результате, как в случае добавления Н+-ионов, так и в случае добавления ОН--ионов, эти ионы связываются и потому кислотность раствора практически не меняется.
Кислотность растворов принято выражать так называемым водородным показателем pH (для нейтральныхрастворов pH=7, для кислых — pH меньше, а для щелочных — больше 7). Приливание к 1 л чистой воды 100 мл 0,01 молярного раствора HCl (0,01 М) изменяет pH от 7 до 3. Приливание того же раствора к 1 л буферной системы CH3COOH + CH3COONa (0,1 М) изменит pH от 4,7 до 4,65, то есть всего на 0,05. В присутствии 100 мл 0,01 Мраствора NaOH в чистой воде pH изменится от 7 до 11, а в указанной буферной системе лишь от 4,7 до 4,8. Кроме рассмотренного, имеются многочисленные другие буферные системы (примеры см. в табл.). Кислотность (и, следовательно, pH) буферной системы зависит от природы компонентов, их концентрации, а для некоторых буферных систем и от температуры. Для каждой буферной системы pH остаётся примерно постоянным лишь до определённого предела, зависящего от концентрации компонентов.
Примеры буферных систем
| Компоненты (концентрации по 0,1 г мол/л) | pH (при 15—250C) |
| Уксусная кислота + ацетат натрия, CH3COOH + CH3COONa | 4,7 |
| Лимоннокислый натрий (двузамещеный), C6H6O7Na2 | 5,0 |
| Борная кислота + бура, Н3ВО3 + Na2B4O7 10H2O | 8,5 |
| Борная кислота + едкий натр, Н3ВО3 + NaOH. | 9,2 |
| Фосфат натрия (двузамещеный)+ + едкий натр, Na2HPO4 + NaOH | 11,5 |
Буферные системы широко используются в аналитической практике и в химическом производстве, так как многиехимические реакции идут в нужном направлении и с достаточной скоростью лишь в узких пределах pH. Буферные системы имеют важнейшее значение для жизнедеятельности организмов; они определяют постоянство кислотности различных биологических жидкостей (крови, лимфы, межклеточных жидкостей). Основные буферные системыорганизма животных и человека: бикарбонатная (угольная кислота и её соли), фосфатная (фосфорная кислота и еёсоли), белки (их буферные свойства определяются наличием основных и кислотных групп). Белки крови (прежде всего гемоглобин, обусловливающий около 75% буферной способности крови) обеспечивают относительную устойчивость pH крови. У человека pH крови равен 7,35—7,47 и сохраняется в этих пределах даже при значительных изменениях питания и др. условий. Чтобы сдвинуть pH крови в щелочную сторону, необходимо добавить к ней в 40—70 раз больше щёлочи, чем к равному объёму чистой воды. Естественные буферные системы в почве играют большую роль в сохранении плодородия полей.
Вопрос
Гидролизом («гидро» – вода, «лиз» – разложение) называются реакции веществ водой. Гидролиз возможен для различных неорганических и органических соединений, но в неорганической химии он наиболее характерен для солей.
Гидролизом солей являются реакции, обратные реакциям нейтрализации слабых кислот и оснований. При взаимодействии сильных кислот со щелочами происходит полная нейтрализация этих веществ и среда становится нейтральной. Но при взаимодействии слабых электролитов полная нейтрализация невозможна. Например, взаимодействие циановодородной кислоты с гидроксидом аммония обратимо; обратная реакция цианида аммония с водой как раз и является реакцией гидролиза этой соли:
NH4CN + H2O D NH4OH + HCN
Для солей, образованных сильными основаниями (щелочами) и сильными кислотами (NaCl, CaCl2, KNO3 и т.д.), реакции гидролиза не характерны. В растворах таких солей равновесие диссоциации воды практически не нарушается и среда растворов – нейтральная (pH = 7).
Остальные соли по типу гидролиза подразделяются на три группы.
1. Соли, образованные сильными основаниями (щелочами) и слабыми кислотами: Na2CO3, KCN, Na2S, K2SiO3 и т.д. Гидролиз этих солей идёт по аниону с образованием слабых кислот, и среда раствора становится щелочной (pH > 7), например:
KCN + H2O D HCN + KOH; CN– + H2O D HCN + OH–
2. Соли, образованные слабыми основаниями и сильными кислотами: NH4Cl, ZnCl2, FeSO4, Al(NO3)3 и т.д. Гидролиз таких солей идёт по катиону с образованием слабого основания, и среда раствора становится кислотной (pH < 7), например:
 D
D 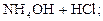
 D
D 
3. Соли, образованные слабыми основаниями и слабыми кислотами: NH4CN, Al(CH3COO)3, Cr2S3 и т.д. Такие соли гидролизуются по катиону и по аниону с образованием слабого основания и слабой кислоты, например:
NH4CN + H2O D NH4OH + HCN; 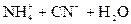 D
D 
Среда растворов этих солей зависит от продуктов реакции: если основание имеет бóльшее значение константы диссоциации, то среда будет щелочной, а если кислота – то кислотной.
У солей, заряды ионов которых больше единицы, гидролиз протекает ступенчато. При этом на первой ступени образуются кислые (при гидролизе по аниону) или основные (при гидролизе по катиону) соли, которые могут подвергаться дальнейшему взаимодействию с водой. Но последующие ступени гидролиза при обычных условиях выражены настолько слабо, что их можно не принимать во внимание.
Пример 23. Опишите ступенчатый гидролиз карбоната натрия, ортофосфата калия, нитрата цинка и хлорида алюминия.
Решение. 1) Гидролиз карбоната натрия теоретически может протекать в две ступени:
– первая:  D
D 
 D
D 
– вторая:  D
D 
 D
D 
Но вторая ступень гидролиза при обычных условиях практически не идёт и её можно не учитывать. Отсутствие второй ступени гидролиза можно объяснить тем, что накопление в растворе OH–-ионов при гидролизе по первой ступени препятствует их образованию по второй.
2) При гидролизе ортофосфата калия возможны три ступени:
– первая:  D
D 
 D
D 
– вторая:  D
D 
 D
D 
– третья:  D
D 
 D
D 
но практически фиксируются первая ступень и слабые признаки второй, а третья ступень при обычных условиях не наблюдается.
3) Гидролиз нитрата цинка идёт в две ступени:
– первая:  D
D 
 D
D 
– вторая:  D
D 
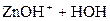 D
D 
Но вторая ступень гидролиза практически не идёт. Её отсутствие можно объяснить тем, что накопление в растворе H+-ионов при гидролизе по первой ступени препятствует их образованию по второй.
4) При гидролизе хлорида алюминия возможны три ступени:
– первая:  D
D 
 D
D 
– вторая:  D
D 
 D
D 
– третья:  D
D 
 D
D 
Реально при обычных условиях почти нацело проходит гидролиз по первой ступени и частично по второй, а по третьей ступени гидролиз практически не идёт.
Вопрос
Скорость химической реакции определяется количеством вещества, прореагировавшего в единицу времени в единице объема.
Если при постоянных объеме и температуре концентрация одного из реагирующих веществ уменьшилась от с1 до с2 за определенный промежуток времени от t1 до t2, то скорость химической реакции равна:
v= - (c2 - c1 ) / (t2 - t1 )=∆c/∆t,
Знак «-» в правой части уравнения означает: при мере протекания реакции (t2 - t1) > 0 концентрация реагирующих веществ убывает (с2 - с1 < 0), а так как скорость реакции не может быть отрицательной, перед уравнением ставится знак «-».
Концентрация выражается в моль/л, а скорость – моль/(л·с).
Скорость химической реакции зависит:
1. От природы реагирующих веществ;
2. От условий, в которых она протекает (концентрация, температура, наличие катализатора).
Природа химических реагентов оказывает ключевое влияние на скорости реакций. (Например, водород реагирует со фтором уже при комнатной температуре и очень энергично, а при взаимодействии с йодом - реакцию надо проводить при значительном нагревании).
Количественная зависимость между скоростью реакции и молярной концентрацией реагирующих веществ описывается основным законом химической кинетики – законом действующих масс.
Закон действующих масс: скорость химической реакции при постоянной температуре пропорциональна произведению концентраций реагирующих веществ.
aA + bB +… → cC + dD +….
В соответствии с законом скорость химической реакции может быть представлена в следующем виде:
v= k[A]vA[B]vB,
где k - коэффициент, не зависящий от концентрации, называется константой скорости реакции,
vA и vB – постоянные числа – показатели порядка скорости реакции по реагентам А и В.
Сумма vA + vB = v называется суммарным (общим) порядком реакции.
Следует отметить, что показатели порядка скорости реакции vA и vB о реагентам никогда не равны стехиометрическим коэффициентам a и b (исключение может быть только в одном случае – если реакция представляет собой элементарный акт).
Для сложных реакций показатели порядка реакции не равны стехиометрическим коэффициентам и определяются только экспериментально.
Такая зависимость справедлива для газов и жидкостей (гомогенные системы). Для гетерогенной реакции (с участием твердых веществ) скорость реакции зависит еще и от величины поверхности соприкосновения между реагирующими веществами. Любое увеличение площади поверхности приводит к увеличению скорости реакции.
 2018-01-21
2018-01-21 1398
1398








