При увеличении концентрации одного из реагирующих веществ равновесие смещается в сторону расхода этого вещества.
Fe + S 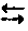 FeS,
FeS,
При увеличении концентрации железа или серы, равновесие будет сдвигаться в сторону расхода этого вещества, т.е. вправо.
Влияние давления на химическое равновесие.
Учитывается только в газовых фазах!
При увеличении давления равновесие смещается в сторону уменьшения количеств газообразных веществ. Если реакция протекает без изменения количеств газообразных веществ, то давление на равновесие никак не влияет.
N2(г) + 3H2(г) 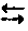 2NH3(г),
2NH3(г),
Слева 4 моль газообразных реагентов, справа – 2, поэтому при увеличении давления равновесие будет смещаться вправо.
N2(г)+O2(г) = 2NO(г),
Слева 2 моль газообразных веществ и справа, поэтому давление не влияет на равновесие.
Влияние температуры на химическое равновесие.
При изменении температуры изменяется как и прямая, так и обратна реакция, но в различной степени.
При повышении температуры равновесие смещается в сторону эндотермической реакции.
N2(г) + 3H2(г) 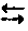 2NH3(г) +Q,
2NH3(г) +Q,
Эта реакция протекает с выделение тепла (экзотермическая), поэтому повышение температуры будет смещать равновесие в сторону исходных продуктов (обратная реакция).
Вопрос
Для определения степени окисления используют следующие правила:
1. Степень окисления элемента в простом веществе равна нулю (Н20, О30, N20, металлы);
2. Постоянную степень окисления имеют элементы:
· щелочных металлов (+1);
· щелочноземельных металлов (+2);
· кислорода (-2), кроме пероксидов (-1), фторида кислорода ОF2 (+2);
· водорода (+1) (кроме гидридов металлов (-1).
3. Сумма степеней окисления всех элементов в соединении равна нулю, а в сложном ионе равна заряду иона.
Для элементов, имеющих непостоянную степень окисления, её значение можно определить, зная формулу соединения и степень окисления одного из элементов.
Пример определения степени окисления в соединениях: СО, СН4, NН3, Cl2O7, С2Н5OH. Степень окисления кислорода (-2), водорода(+1).
СО x+(-2)=0 x=+2 С+2О-2,
Cl2O7 2x+7(-2)=0 x=+7 Cl2+7O7-2,
СН4 x+4(+1)=0 x=-4 С-4H4+1,
NН3 x+3(+1)=0 x=-3 N-3H3+1,
С2Н5OH 2x+6(+1)+(-2)=0 x=-2 C2-2H5+1O-2H+1,
Химические реакции делятся на два типа:
· реакции без изменения степени окисления;
· реакции с изменением степени окисления.
Реакции, в которых происходит изменение степеней окисления элементов, входящих в состав взаимодействующих соединений, называются окислительно-восстановительными.
Примером окислительно-восстановительной реакции является взаимодействие металла с кислотой:
Zn0 + 2H+1Cl-1 = Zn+2 Cl2-1 + H20↑,
Окисление − это процесс отдачи электронов веществом, сопровождающийся повышение степени окисления элемента.
Zn0 - 2ē = Zn+2,
Восстановление − это процесс присоединения электронов веществом, сопровождающийся понижением степени окисления элемента.
2H+1 + 2ē = H20,
Окислитель − вещество, принимающие электроны в процессе реакции.
Восстановитель − вещество, отдающие электроны в процессе реакции.
Химические реакции можно разделить на следующие группы:
1. Протекающие без изменения степени окисления реагирующих веществ:
NaCl + AgNO3 = NaNO3 + AgCl↓,
2. Окислительно-восстановительные реакции, в результате чего изменяется степень окисления реагента (или нескольких):
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2O,
Окисление – явление, в результате чего частица отдает электрон, в результате чего он имеет положительный заряд:
Mg0 - 2e = Mg2+,
Br- - e = Br0.
Восстановление – явление, в результате чего частица с вакантным местом принимает электрон.
Mn0 – 2e = Mn+2,
Окислитель в ходе процесса принимает е-, а восстановитель отдает его. Окислитель восстанавливается, а восстановитель – окисляется. Тип связи тут не играет значения.
Одним из типов реакций является диспропорционирование – явление, когда одно и то же вещество является и восстановителем и окислителем:
HOCl + HCl = Cl2+ H2O.
Вопрос
В зависимости от того, находятся ли атомы, выполняющие в реакции функцию окислителя (акцептора электронов) и восстановителя (донора электронов) в одном или в различных веществах, все окислительно-восстановительные процессы можно разделить на три типа: межмолекулярные, внутримолекулярные и диспропорционирования.
В межмолекулярных (межатомных) реакциях окислительные функции выполняют одни вещества, а восстановительные – другие. Например, в реакции H2S + Cl2 = S + 2HCl электроны от восстановителя – молекулы сероводорода – переходят к окислителю – молекуле Cl2.
В реакциях внутримолекулярного окисления-восстановления одна часть молекулы – окислитель, другая – восстановитель. Простейшими примерами могут служить реакции термического разложения вещества:

|
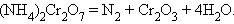
|
Реакции диспропорционирования (самоокисления-самовосстановления) протекают с одновременным уменьшением и увеличением степени окисления атомов одного и того же элемента. Они характерны для соединений или простых веществ, состоящих из промежуточных степеней окисления данного элемента:

|
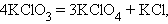
|
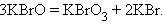
| |||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||
Вопрос
Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — red uction- ox idation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ). Примером окислительно-восстановительного электрода являются: Pt/Fe3+,Fe2+
Стандартный окислительно-восстановительный потенциал Е равен потенциалу системы, в которой активность окисленной и восстановленной форм данного вещества равны единице.
Стандартный окислительно-восстановительный потенциал ф системы С - f 14Н 6е - 2Сг3 Ц - 7Н2О равен 1 33 В.
Стандартные окислительно-восстановительные потенциалы позволяют определить возможность или невозможность сосуществования тех или других веществ в данной среде; например, в воде в присутствии растворенного кислорода не могут находиться сероводород, сульфиты и другие вещества с меньшими окислительно-восстановительными потенциалами.
Стандартный окислительно-восстановительный потенциал является количественной характеристикой как процесса окисления, так и обратного ему процесса восстановления.
Стандартные окислительно-восстановительные потенциалы всех металлов первого переходного ряда, за исключением меди (и серебра во втором переходном ряду), в системах М2 / М отрицательны. В соответствии с этим металлы первого ряда должны располагаться в электрохимическом ряду напряжений выше водорода и вытеснять водород из минеральных кислот.
Стандартный окислительно-восстановительный потенциал Ф мп2 / мп4 равен 1 58 в, следовательно, конкурирующим анодным процессом может быть окисление Н2О до кислорода. Поэтому процесс нужно вести с анодами из материалов, на которых перенапряжение выделения кислорода велико. Материалы для анода - платина, свинец, покрытый двуокисью, и графит. Платину обычно не применяют из-за ее дороговизны. Свинцовые аноды имеют тот недостаток, что загрязняют двуокись марганца двуокисью свинца. Графитовые аноды лишены этого недостатка, но они из-за частичного выделения кислорода постепенно сгорают, так что требуют периодической замены.
Стандартные окислительно-восстановительные потенциалы характеризуют силу или активность окислителей и восстановителей в химических реакциях.
Стандартный окислительно-восстановительный потенциал Е равен потенциалу системы, в которой активность окисленной и восстановленной форм данного вещества равны единице.
Стандартные окислительно-восстановительные потенциалы связаны с соответствующими изменениями свободной энергии уравнением ДС - nFE (см. гл. Изменение свободной энергии для любого превращения не зависит от того, посредством каких стадий осуществляется это превращение.
Стандартные окислительно-восстановительные потенциалы позволяют определить возможность или невозможность сосуществования тех или других веществ в данной среде; например, в воде в присутствии растворенного кислорода не могут существовать сероводород, сульфиты и другие вещества с меньшим окислительно-восстановительным потенциалом.
ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ, разность электростатич. потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено пространств. разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлич. электродом и р-ром электролита пространств. разделение зарядов связано со след. явлениями: переносом ионов из металла в р-р в ходе установления электрохим. равновесия, кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллич. решетки, специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд пов-сти металла равен нулю (см. Потенциал нулевого заряда).
Абс. величину электродного потенциала отдельного электрода определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого электрода и нек-рого стандартного электрода сравнения. Электродный потенциал равен эдс электрохим. цепи, составленной из исследуемого и стандартного электродов (диффузионный потенциал между разными электролитами, обусловленный различием скоростей движения ионов, при этом должен быть устранен). Для водных р-ров в качестве стандартного электрода обычно используют водородный электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал к-рого при давлении водорода 0,101 МПа и термодинамич. активности а ионовН+ в р-ре, равной 1, принимают условно равным нулю (водородная шкала электродных потенциалов). При схематич. изображении цепи водородный электрод всегда записывают слева; напр., потенциал медного электрода в р-ре солимеди равен эдс цепи Pt, H2|HCl  CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на фанице НС1 и СuС12 устранен).
CuCl2|Cu|Pt (две штриховые черты означают, что диффузионный потенциал на фанице НС1 и СuС12 устранен).
Если исследуемый электрод находится в стандартных условиях, когда активности всех ионов, определяющих электродный потенциал, равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение электродного потенциала наз. стандартным (обозначение E°).
Оно связано со стандартным изменением энергии Гиббса 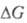 и константой равновесия Кр электрохим. р-ции ур-нием:
и константой равновесия Кр электрохим. р-ции ур-нием: 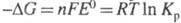 , где F - число Фарадея; п - число электронов, участвующих в р-ции; R - газовая постоянная; Т - абс. т-ра. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах р-ции сведены в спец. таблицы (подробнее см. Стандартный потенциал).
, где F - число Фарадея; п - число электронов, участвующих в р-ции; R - газовая постоянная; Т - абс. т-ра. Значения E° электрохим. систем по отношению к водородному электроду и протекающие на электродах р-ции сведены в спец. таблицы (подробнее см. Стандартный потенциал).
Зависимость электродного потенциала от термодинамич. активностей ai участников электрохим. р-ции выражаетсяНернста уравнением:

где vi - стехиометрич. коэф. участника р-ции, причем для исходных в-в это отрицат. величина, а для продуктов р-ции -положительная.
Если через электрод протекает электрич. ток, электродный потенциал отклоняется от равновесного значения из-за конечной скорости процессов, происходящих непосредственно на границе электрод - электролит
Вопрос
Атом имеет планетарную модель строения.
Вокруг ядра на значительном расстоянии от него вращаются электроны – отрицательно заряженные частицы, суммарный заряд которых нейтрализует положительный заряд ядра и делает атом электронейтральным.
Электроны образуют электронную оболочку атома.
Ядро атома состоит из нуклонов N – протонов p+ (положительно заряженных частиц) и нейтронов n0 (нейтрально заряженных частиц), т.е.
N=p+n
Число протонов соответствует порядковому номеру элемента в периодической таблице Д.И. Менделеева (Z).
Число нейтронов может изменяться.
Зная порядковый номер элемента Z, который соответствует числу протонов р+, и массовое число (массу ядра) А, равное сумме протонов и нейтронов, можно найти число нейтронов N:
N=A-Z
| Частица | Заряд | Масса, а.е.м. | Соответсвие |
| протон p+ | +1 | соответствует порядковому номеру элемента | |
| нейтрон n0 | N=A-Z | ||
| электрон ē | –1 | 5,48×10-4 | соответствует порядковому номеру элемента |
Элементы с одинаковым атомным номером, но с различным числом нейтронов, называются изотопами.
При химических реакциях ядра атомов не изменяются, изменяется только строение электронных оболочек.
Электроны составляют энергетический уровень, на котором может располагаться определённое число электронов, имеющих близкие энергетические значения. Максимальное число электронов на энергетическом уровне – 2n2. Энергетические уровни подразделяются на электронные подуровни s-, p-, d-, f- орбитали. Количество подуровней равно номеру энергетического уровня.
 2018-01-21
2018-01-21 1539
1539
