| VM | = | V |
| ----- | ||
| n |
Количество вещества эквивалента – Количество вещества химического эквивалента вещества В - n эк(В) - величина, пропорциональная числу химических эквивалентов этого вещества N эк(B):
n эк(B)= N эк(B)/ N A,
где NA - постоянная Авогадро, Единица измерения количества вещества химического эквивалента - моль.
Эквивалентная масса – масса 1 эквивалента элемента. (изм. в г/моль-экв.)
Закон эквивалентов – массы реагирующих и образующихся веществ относятся между собой как эквивалентные массы этих веществ.
Метод молекулярных орбиталей исходит из того, что каждую молекулярную орбиталь представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Например, в молекуле водорода в образовании МО могут участвовать только 1s атомные орбитали двух атомов водорода, которые дают две МО, представляющие собой сумму и разность атомных орбиталей 1s1 и 1s2 √ МО╠ = C11s1 ╠C21s2.
Поскольку ядра во взаимодействующих атомах водорода одинаковы, то и вклад атомных орбиталей будет одинаковым, что обеспечивается равенством коэффициентов, с которыми s-орбитали участвуют в линейной комбинации (C1 = C2 = C). Поскольку должно выполняться требование, что сумма квадратов коэффициентов при АО равна 1, то имеем 2C2 = 1, откуда 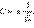 Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода:
Опуская этот нормировочный множитель, запишем две молекулярные орбитали как сумму и разность АО атомов водорода: 
|
|
|
Электронная плотность этих двух состояний пропорциональна |MO╠|2. Поскольку в молекуле водорода взаимодействие возможно только по оси молекулы, то каждая из MO╠ может быть переобозначена как усв = 1s1 + 1s2 и у* = 1s1 √ 1s2 и названа соответственно связывающей (усв) и разрыхляющей (у*) молекулярными орбиталями
Электронная плотность посередине между ядрами для усв значительна, а для у* равна нулю. Отрицательно заряженное электронное облако, сконцентрированное в межъядерном пространстве, притягивает положительно заряженные ядра и соответствует связывающей молекулярной орбитали усв. А МО с нулевой плотностью в межъядерном пространстве соответствует разрыхляющей орбитали у*. Состояния усв и у* отвечают разным уровням энергии, причем молекулярная орбиталь усв имеет более низкую энергию по сравнению с исходными АО двух невзаимодействующих атомов водорода 1s1 и 1s2 (рис. 3.8).
Рисунок 3.8.
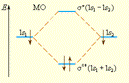 Энергетическая диаграмма атомных и молекулярных уровней водорода
Энергетическая диаграмма атомных и молекулярных уровней водорода
Переход двух электронов на МО усв способствует понижению энергии системы; этот энергетический выигрыш равен энергии связи между атомами в молекуле водорода H√H. Даже удаление одного электрона с МО (усв)2 c образованием (усв)1 в молекулярном ионе 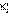 оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
оставляет эту систему более устойчивой, чем отдельно существующие атом H и ион H+.
|
|
|
Заселение электронами связывающей МО усв стабилизирует систему, а заселение разрыхляющих √ дестабилизирует ее.
Согласно методу МО порядок (кратность) связи n определяется полуразностью числа связывающих Nсв и разрыхляющих Nраз электронов: 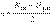
При нулевой кратности связи, как в случае He2, молекула не образуется.
7. Строение атомов химических элементов и закономерности в изменении их свойств на примере: а) элементов одного периода; б) элементов одной главной подгруппы. Изотопы.
Резерфорд в 1911г. Предложил следующую схему строения атома, получившую название ядерной модели атома. Атом состоит из положительно заряженного ядра, в котором сосредоточена преобладающая часть массы атома и вращающихся вокруг него электронов.
Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов, поэтому атом в целом электронейтрален. Заряд ядра численно равен порядковому номеру элемента в периодической таблице. Атомные ядра состоят из протонов р и нейтронов n. Протон-элементарная частица, обладающая массой 1,0728 а.е.м. и положительным зарядом равным по абсолютной величине заряду электрона. Нейтрон также представляет собой элементарную частицу, но не обладающую электрическим зарядом. Масса нейтрона равна 1,00867 а.е.м. Между образующими ядро частицами действуют два вида сил: электростатические силы отталкивания протонов и ядерные силы, действующие между протонами и нейтронами.
Атомы, обладающие одинаковым зарядом ядра, но разным числом нейтронов, называются изотопами. Для обозначения изотопов пользуются обычными символами элементов, добавляя к ним слева вверху индекс, указывающий массовое число изотопа.
Порядковый номер химического элемента показывает численное значение заряда его ядра (т.е. число протонов в ядре), а также общее число электронов, движущихся около ядра.
Каждый следующий по порядку атом имеет на один протон больше в своем ядре и на один электрон больше в своей электронной оболочке. При движении по периоду слева направо с ростом заряда ядра атома уменьшается его размер и возрастает энергия связи электронов с ядром. Это проявляется в том, что металличность элемента (способность отдавать свои валентные электроны) снижается, и одновременно возрастает стремление атома к присоединению электронов (т.е. его неметалличность).
В 4-м периоде эта закономерность наблюдается от калия до брома. Электронные формулы некоторых элементов из этого периода:
+19 К 1s22s22р63s2Зр6Зd0 4s1 (самый активный металл 4-го периода)
+32 Ge 1s22s22р63s2Зр6Зd10 4s24p2 (амфотерный элемент)
+35,Вг 1s22s22р63s2Зр6Зdl0 4s24р5 (самый активный неметалл 4-го периода)
+36 Кr 1s22s22р63s2Зр6Зdl04s24р6 (благородный газ) "
(подчеркнуты валентные электроны)
Постепенное заполнение электронами внешнего энергетического уровня закономерно меняет свойства атома от металлических к неметаллическим. Снижается восстановительная и возрастает окислительная способность атомов.
В группах сверху вниз с ростом размера атома осла6евает энергия связи его электронов с ядром, т.е. растет восстановительная способность атома (металличность), а снизу вверх усиливается окислительная способность.
Например, такая закономерность видна в IV А - группе:
от металла свинца (РЬ) к неметаллу углероду (С).
В группах объединены элементы, имеющие сходное строение атома "на уровне внешнего электронного слоя. Так, и у атома углерода, и у атома свинца внешняя электронная оболочка содержит четыре электрона (два s- и два р-электрона).
+6 C 1s2 2s22p2
+82 Pb … 6s26p2
В периоде характер оксидов элементов меняется от основного (К2О, СаО) к кислотному (SеОз), а в группах сверху вниз ослабевает кислотный характер оксидов.
|
|
|
8. Квантово-механическая модель атома.
Диаметр атома равен 10-8 см. Диаметр ядра от 10-13 до 10-14 см. Основу квантовой механики составляют представления о двойственности поведения микрочастиц. Двойственность заключается в следующем: с одной стороны при одних физических условиях микрочастицы ведут себя как в-ва (имеют четкую траекторию движения, массу, импульс), при других условиях они проявляют волновые св-ва: E=hν – ур-е Планка. E=mc2 – ур-е Эйнштейна. Постулаты Бора: 1) Существуют сос-ния атома водорода, при которых возможно движение электрона относительно ядра без выделения или поглощения энергии. 2) При переходе из одного такого сос-ния в другое атом излучает и поглощает квант энергии.
11. Заполнение электронами орбиталей у элементов малых периодов на примере элементов третьего периода.
Na(натрий11) - 1s2, 2s2, 2p6, 3s1
Mg(магний12) - 1s2, 2s2, 2p6, 3s2
Al(алюминий13) -1s2, 2s2, 2p6, 3s2, 3p1
Si(кремний14) - 1s2, 2s2, 2p6, 3s2, 3p2
P(фосфор15) - 1s2, 2s2, 2p6, 3s2, 3p3
S(сера16) - 1s2, 2s2, 2p6, 3s2, 3p4
Cl(хлор17) -1s2, 2s2, 2p6, 3s2, 3p5
Ar(аргон18) - 1s2, 2s2, 2p6, 3s2, 3p6
12. Заполнение электронами орбиталей у d-элементов на примере Mn, Pd, Cd.
Mn(марганец25) -1s2, 2s2, 2p6, 3s2, 3p6, 3d5, 4s2.
Pd(палладий46) -1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 5s0.
Cd(кадмий48) - 1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 5s2.
13. Заполнение электронами орбиталей у f-элементов на примере Lu, Sm.
Lu(лютеций71)-1s2, 2s2, 2p6, 3s2, 3p6, 3d10, 4s2, 4p6, 4d10, 4f14, 5s2, 5p6, 5d1,6s2.
Sm(самарий62)-4f6,5s2,5p6,6s2
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20√100 кДжмоль√1. Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей.
|
|
|
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при √100 °С, а кипела при √80 °С.
15. типы химических связей.
Химическая связь — это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи: а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того лее химического элемента. Такую связь имеют простые вещества, например О2; N2; C12. Можно привести схему образования молекулы водорода: 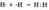 (на схеме электроны обозначены точками).
(на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов. схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так:
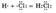 Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд 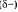 , а на атоме водорода — частичный положительный
, а на атоме водорода — частичный положительный 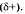 . Таким образом, молекула становится полярной:
. Таким образом, молекула становится полярной: 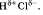
Ковалентная связь √ наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H√H, F√F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200√2000 кДжмоль√1.
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. (HCl, H2O). Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(чA √ чB) + 3,5(чA √ чB)2, где чA и чB √ электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемости ковалентная связь обладает свойством насыщаемости √ способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи √ направленности √ речь ниже (см. метод валентных связей).
Ионная связь √ частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~310√29 Клм, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na0,8+Cl0,8√.
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
17. Метод валентных связей. Гибридизация атомных орбиталей и геометрия молекул. Полярность молекул. пространственное строение молекул BF3, H2O, CH4.
Метод валентных связей.
А) химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар.
Б) атомы, вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.
В) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.
Г) характеристики химической связи (энергия, длина, полярность) определяются типом перекрывающихся АО.
Метод валентных связей. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов.
Гибридизация атомных орбиталей – изменение формы некоторых атомных орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей. гибридизация осуществляется тогда, когда в образовании связей данного атома участвуют электроны разного типа.
Наиболее распространены следующие типы гибридизации:
a) sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые гибридные орбитали, оси которых расположены под углом 109,50 друг к другу. sp3-гибридизация имеет место в молекулах NH3, Н2О и во всех предельных углеводородах.
b) sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые гибридные орбитали, оси которых расположены под углом 1200 друг к другу. sp2-гибридизация имеет место в молекулах BF3, AlCl3, а также во всех этиленовых и ароматических углеводородах.
c) sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые гибридные орбитали, оси которых расположены под углом 1800 друг к другу. sp-гибридизация имеет место в молекулах BeH2, BeF2, CO2, а также во всех ацетиленовых углеводородах.
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием неподеленных электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
18. Метод молекулярных орбиталей. Порядок и энергия связи. Применение ММО для описания ковалентной связи в гомоядерных двухатомных молекулах элементов второго периода периодической системы на примере О2.
ММО – квантово-химический метод описания химической связи, рассматривающий молекулу и любую многоатомную систему как «многоядерный атом», в котором электроны заселяются по молекулярным орбиталям. Основные положения:
Основные положения ММС: 1) рассматривается деколализация только валентных электронов ns (n-2)d np 2) рассматривают фолновые ф-ции электронов в поле нескольких центров, имеющих определённые эффективные заряда. Эти волновые ф-ции-молекулярные орбитали (МО) 3) МО рассматриваются как результат комбинации волновых ф-ций электронов сближающихся атомов.
. В молекуле О2 в образовании хим.связей принимают участие по четыре 2 p -электрона каждого атома. Шесть электронов занимают три связывающих МО, а два размещаются на разрыхляющих МО π разр 2 p. Здесь избыток числа связывающих электронов над разрыхляющими равен 4, а кратность связи 2. В молекуле О2 имеются два неспаренных электрона, следовательно, она является парамагнетиком. При образовании иона О2+ из молекулы О2 удаляется электрон, находящийся на разрыхляющей орбитали, т.е. электрон обладающий максимальной энергией. Отсюда увеличивается кратность связи и образуется более прочная молекула.
Порядок и энергия связи. В методе МО вместо кратности связи вводится понятие порядок связи n, который равен половине разности числа электронов на связывающих 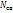 и разрыхляющих
и разрыхляющих 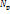 МО
МО 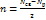 .
.
Если число 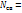
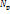 , то n=0 и молекула не образуется. С увеличением n в однотипных молекулах растет энергия связи.
, то n=0 и молекула не образуется. С увеличением n в однотипных молекулах растет энергия связи.
В отличие от ВС в методе МО допускается, что химическая связь может быть образована не только парой, но и одним электроном и соответственно порядок связи может быть не только целым, но и дробным числом: n=1/2, 1, 3/2, 2, 5/2, 3…
20. Металлическая связь. Понятие электронного газа. проводники, полупроводники, диэлектрики.
Металлы отличаются от других веществ свойствами: 1) повышенная электро- и теплопроводность; вывод: электроны свободно перемещаются по куску металла; 2) в обычных условиях практически все металлы являются твердыми веществами; вывод: металлы не имеют ковалентных связей, носящих направленный характер.Электроны в металле становятся общими для всего куска, и такую комбинацию электронов называют ЭЛЕКТРОННЫМ ГАЗОМ. Связи описывают с помощью метода кристаллических орбиталей.Валентные электроны, осуществляющие химическую связь, принадлежат не двум или нескольким определённым атомам, а всему кристаллу металла. При этом валентные электроны способны свободно перемещаться в объёме кристалла. Образованную подобным образом химическую связь называют МЕТАЛЛИЧЕСКОЙ ХИМИЧЕСКОЙ СВЯЗЬЮ, а совокупность «свободных» электронов в металле - ЭЛЕКТРОННЫМ ГАЗОМ. Металлы отличаются высокой электропроводимостью и теплопроводностью. В обычных условиях являются кристаллическим веществом. В кристалле металла орбитали соседних атомов перекрываются. Количество орбиталей у атомов металла значительно больше, чем количество электронов на них. ПОЛУПРОВОДНИКИ - при низких температурах их электрическое сопротивление весьма велико и в этих условиях они проявляют свойства изоляторов. Однако при нагревании или при освещении электрическая проводимость полупроводников резко возрастает и может достигать величин, сравнимых с проводимостью металлов. В отличии от металлов кристаллы простых веществ, образованных неметаллами, обычно не обладают заметной электронной проводимостью; они представляют собой изоляторы (ДИЭЛЕКТРИКИ). Металлы являются ПРОВОДНИКАМИ.
24. Понятие о координационном числе центрального атома и дентатности лигандов. Хелаты.
Координационное число – число мест во внутренней сфере комплекса, которые могут быть заняты лигандами
У центрального атома есть такая характеристика, как КООРДИНАЦИОННОЕ ЧИСЛО - это количество связей, которые центральный атом может образовывать с лигандами. Как правило, для заряженных комплексообразователей координационное число в два раза превышает его заряд.
Лиганды могут занимать в координационной сфере одно или несколько мест, т.е. образовывать одну или несколько связей; это их свойство называется ДЕНТАНТНОСТЬЮ.
ХЕЛАТЫ - комплексные соединения, в которых связь между центральным атомом и лигандами является донорно-акцепторной. Различают монодентантные и полидентантные комплексы.
Лиганды могут быть ионного и молекулярного происхождения: 1) Молекулярные: Амин (NH3), аква (H2O), карбонил (CO), гидразин (N2H4), метиламин (СР3ТР2); 2) Ионыные: Хлоро (Cl-), фторо(F-), циано (CN-), нитро (NO2 -), гидроксо (OH-). Образование комплексов осуществляется за счет донорно-акцепторного взаимодействия неподеленных электронных пар лигандов и свободных орбиталей комплексообразователя. Количество связей, образуемых лигандом с комплексообразователем, называется координационной емкостью (дентальностью). Известны моно-, ди-, три-, и более дентантные лиганды.
23. Диссоциация комплексных соединений. Ступенчатая диссоциация комплексных ионов. Общая (полная) константа нестойкости комплексных ионов как мера их устойчивости.
Диссоциация комплексных соединений и ионов. Между ионом внешней и внутренней сфер возникает ионная связь, поэтому комплексные соединения диссоциируют на ионы необратимо:K3[Fe(CN)6]=3K++[Fe(CN)6]3-.Между комплексообразователем и лигандами возникает донорно-акцепторная связь (комплексообразователь - акцептор, лиганды - доноры), поэтому комплексный ион диссоциирует как слабый электролит:[Fe(CN)6]3- ↔Fe3+ +6CN-Диссоциация комплексных ионов имеет количественную характеристику - константу нестойкости (Кн):
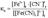 В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.
В зависимости от константы нестойкости комплексные ионы подразделяются на нестойкие, устойчивые, очень устойчивые.
| Кнест | 10-1÷10-3 | 10--4÷10-20 | <10-20 |
| Устойчивость ком. ионов | Нестойкие | Устойчивые | Очень устойчивые |
| Способ разрушения | Разбавлением раствора | Химическим воздействием на лиганды | Практически неразрушимы |
Чтобы разрушить комплексный ион, необходимо сместить его равновесие в прямом направлении. Так как при разбавлении растворов диссоциация усиливается, для разрушения неустойчивых комплексных ионов достаточно разбавить раствор водой. Устойчивые комплексные ионы разрушают химическим воздействием, либо на комплексообразователь, либо на лиганды. Это означает, что или комплексообразователь, или лиганды надо удалить из раствора в виде более труднорастворимого соединения, чем разрушаемый комплексный ион. Например, надо разрушить устойчивый ион[Ag(NH3)2]+, имеющий Кн = 10-8.
Если на раствор, содержащий данный ион, воздействовать раствором иодида калия, то ионы серебра будут удалены из раствора в виде AgI, имеющего произведение растворимости, равное 10-17. Если воздействовать азотной кислотой, то лиганды, молекулы NH3, будут связаны в комплексный ион [H(NH3)]+, константа нестойкости которого равна 10-14. В обоих случаях понизится концентрация продуктов реакции:[Ag(NH3)2]+ ↔Ag+ +2NH3 и по принципу Ле-Шателье равновесие реакции сместится в прямом направлении, в сторону разрушения комплексного иона. Процессы комплексообразователя широко используются в аналитической химии. При выборе условий наиболее эффективного разделения ионов исходят из соотношения констант нестойкости образуемых ими комплексных соединений.
 2018-01-21
2018-01-21 376
376







