При взаимодействии спиртов с галогеноводородами применяют водоотнимающие средства (хлоридкальция). 
Билет 5. Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом. Спирты, у которых гидроксильная группа связана с ароматическим кольцом, называются фенолами. Способы получения. 1. Получение из алкенов. Гидратация алкенов протекает по механизму электрофильного присоединения по правилу Марковникова. Это один из наиболее важных промышленных способов получения спиртов. 2. Получение из галогенопроизводных. Галогеналканы гидролизуются под действием водных растворов щелочей. Реакция протекает по механизму нуклеофильного замещения: 3. Восстановление карбонильных соединений. При восстановлении альдегидов образуются первичные спирты, при восстановлении кетонов — вторичные: 2. Получение из ароматических сульфокислот (см. реакцию 3 в разделе “Химические свойства бензола”), реакция проводится при сплавлении сульфокислот со щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:Способы получения. 1. Получение из галогенбензолов. При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол: Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.): Химические свойства. Различают два основных типа реакций спиртов с участием функциональной группы —ОН:
реакции с разрывом связи О—Н:
а) взаимодействие спиртов с щелочными и щелочноземельными металлами с образованием алкоксидов;
б) реакция спиртов с органическими и минеральными кислотами с образованием сложных эфиров;
в) окисление спиртов под действием дихромата или перманганата калия до карбонильных соединений. Скорость реакций, при которых разрывается связь О—Н, уменьшается в ряду:
первичные спирты > вторичные > третичные.
Реакции, сопровождающиеся разрывом связи С—О:
а) каталитическая дегидратация с образованием алкенов (внутримолекулярная дегидратация) или простых эфиров (межмолекулярная дегидратация);
б) замещение группы —ОН галогеном, например при действии галогеноводородов с образованием алкилгалогенидов.
Скорость реакций, при которых разрывается связь С—О, уменьшается в ряду:
Химические свойства. В фенолах р-орбиталь атома кислорода образует с ароматическим кольцом единую p -систему. Вследствие такого взаимодействия электронная плотность у атома кислорода уменьшается, а в бензольном кольце повышается. Полярность связи О—Н увеличивается, и водород ОН-группы становится более реакционноспособным и легко замещается на металл даже при действии щелочей (в отличие от предельных одноатомных спиртов).
Кроме того, в результате такого взаимного влияния в молекуле фенола увеличивается реакционная способность бензольного кольца в орто- и пара-положениях в реакциях электрофильного замещения (галогенирования, нитрования, поликонденсапии и т. д.):
Взаимное влияние атомов в молекуле. Все составляющие молекулу атомы находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается, в основном, через систему ковалентных связей, с помощью так называемых электронных эффектов.Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.Атомы, связанные полярной связью, несут частичные заряды, обозначаемые греческой буквой "дельта" (d). Атом, "оттягивающий" электронную плотность s-связи в свою сторону, приобретает отрицательный заряд d-. При рассмотрении пары атомов, связанных ковалентной связью, более электроотрицательный атом называют электроноакцептором. Его партнер по s-связи соответственно будет иметь равный по величине дефицит электронной плотности, т.е. частичный положительный заряд d+, будет называться электронодонором.
Смещение электронной плотности по цепи s-связей называется индуктивным эффектом и обозначается I.
Индуктивный эффект передается по цепи с затуханием. Направление смещения электронной плотности всех s -связей обозначается прямыми стрелками.
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.Электроноакцепторные заместители, т.е. атом или группа атомов, смещающие электронную плотность s-связи от атома углерода к себе, проявляют отрицательный индуктивный эффект (-I-эффект).Электродонорные заместители, т.е. атом или группа атомов, смещающие электронную плотность к атому углерода от себя, проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, т.е. алкильные радикалы (метил, этил и т.д.). Большинство функциональных групп проявляют -I-эффект: галогены, аминогруппа, гидроксильная, карбонильная, карбоксильная группы. Индуктивный эффект проявляется и в случае, когда связанные атомы углерода различны по состоянию гибридизации. При передаче индуктивного эффекта метальной группы на двойную связь в первую очередь ее влияние испытывает подвижная p-связь.
Влияние заместителя на распределение электронной плотности, передаваемое по p-связям, называют мезомерным эффектом (М). Мезомерный эффект также может быть отрицательным и положительным. В структурных формулах его изображают изогнутой стрелкой, начинающейся у центра электронной плотности и завершающейся в том месте, куда смещается электронная плотность.
Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
Билет6 Этаноламин HO-CH2CH2-NH2 (2-аминоэтанол) — простейший стабильный аминоспирт, вязкая маслянистая жидкость, смешивается с водой во всех отношениях, слабое основание. Водные растворы этаноламина обладают щелочной реакцией и хорошо поглощают кислые газы (диоксид углерода, диоксид серы, сероводород, газообразные и летучие тиолы), регенерируя их при повышении температуры; благодаря этому растворы этаноламина широко используются в качестве абсорбента в различных процессах газоочистки (например, удаление примесей сероводорода, углекислоты и тиолов в нефтегазовой и нефтехимической промышленности) и разделения газов (в частности, абсорбция углекислоты из в производстве водорода конверсией синтез-газа).Этаноламин также является исходным веществом в промышленном синтезе таурина. Холи́н (от греч. χολή — жёлчь) — гидроокись 2-оксиэтилтриметиламмония, [(CH3)3N+CH2CH2OH] OH−. Холин обычно относят к витаминам группы В (витамин B4 или Bp), хотя животные и микроорганизмы способны его синтезировать Впервые получен из жёлчи. Широко распространён в живых организмах. Особенно высоко содержание его в яичном желтке, мозге, печени, почках и мышце сердца.Находится в капусте, шпинате, сое.
В организме из холина синтезируется важнейший нейромедиатор-передатчик нервного импульса — ацетилхолин. Холин является важным веществом для нервной системы и улучшает память.
Входит в состав фосфолипидов (например, лецитина, сфингомиелина).
Участвует в синтезе аминокислоты метионин, где является поставщиком метильных групп.
Влияет на углеводный обмен, регулируя уровень инсулина в организме.
Холин является гепатопротектором и липотропным средством. В комплексе с лецитином способствует транспорту и обмену жиров в печени. Ацетилхолин (лат. Acetylcholinum) — нейромедиатор, осуществляющий нервно-мышечную передачу, а также основной нейромедиатор в парасимпатической нервной системе. Четвертичное аммониевое основание. В организме очень быстро разрушается специализированным ферментом — ацетилхолинэстеразой. Применяется в качестве лекарственного вещества и для фармакологических исследований. Это соединение получают синтетическим путём в виде хлорида или другой соли.Ацетилхолин является четвертичным моноаммониевым соединением. Это химически нестойкое вещество, которое в организме при участии специфического фермента холинэстеразы (ацетилхолинэстеразы) легко разрушается с образованием холина и уксусной кислоты.
Хлорхолинхлорид, ССС, ТУР, [(CH3)3N+CH2CH6ClCl-], химический препарат. Применяется для опрыскивания некоторых растений в период вегетации: пшеницы — против полегания при повышенной влажности почвы (4—6 кг хлорхолинхлорида на 1 га), земляники, яблони и др. культур — для задержки развития пазушных почек, в результате чего усиливается плодоношение. Малотоксичен. это ретардант, биологически активное вещество, способное задерживать процессы роста клетки растяжением. Выпускается в виде 58-70%-ного водного раствора.
билет7 Карбони́льная гру́ппа — функциональная группа >С=O органических соединений.
Альдольно-кротоновая конденсация В молекуле альдегида или кетона на a-атоме углерода (соседнем с карбонильной группой) под влиянием -I-эффекта карбонила понижена электронная плотность. Это вызывает поляризацию связи Сa-Н и способствует отщеплению атома водорода в форме протона (H+). В частности, происходящий под действием оснований отрыв протона от a-углеродного атома, приводит к образованию соответствующего карбаниона. 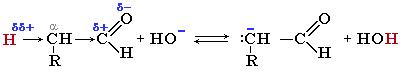
Такие карбанионы могут играть роль нуклеофилов по отношению к карбонильной группе другой молекулы альдегида или кетона. Поэтому оказываются возможными реакции, в которых одна молекула карбонильного соединения (в форме карбаниона) присоединяется к C=O-группе другого карбонильного соединения.
Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль; при проведении реакции в более жестких условиях (при нагревании) альдоль дегидратируется с образованием кротонового альдегида.
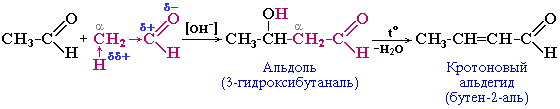
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в a-звене, на которое действуют -I-эффекты двух групп (ОН и С=О).Конденсацию альдегидов или кетонов, протекающую по первому типу, называют альдольной конденсацией, или альдольным присоединением, а по второму типу - кротоновой конденсацией.
Сходства и различия альд. и кет. Альдегиды и кетоны весьма схожи, различие заключается в том, что последние имеют при карбонильной группе два заместителя. Поляризация двойной связи «углерод-кислород» по принципу мезомерного сопряжения позволяет записать следующие резонансные структуры:
С=О ↔ С+—О−
Подобное разделение зарядов подтверждается физическими методами исследования и во многом определяет реакционную способность альдегидов, как выраженных электрофилов. В общем случае химические свойства альдегидов аналогичны кетонам, однако альдегиды проявляют бо́льшую активность, что связано с большей поляризацией связи. Кроме того, для альдегидов характерны реакции, не характерные для кетонов, например гидратация в водном растворе: у метаналя в связи с ещё большей поляризацией связи — полная, а у других альдегидов — частичная:RC(O)H → RC(OH)2H, где R—Н, любой алкильный или арильный радикал.
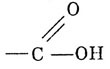
билет8. электронное строение карбоксильной группы.
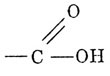
состоит из карбонила
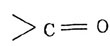
и гидроксила -ОН.
о для карбоновых кислот не характерны ни альдегидные, ни спиртовые свойства.
является самостоятельной функциональной группой, характерной для класса карбоновых кислот. Это объясняется электронным строением и взаимным влиянием функциональных групп и радикала. 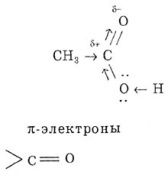
взаимодействуют с р-электронами кислорода гидро-ксигруппы, а это приводит к сопряжению. Поляризация связи С=0 резко возрастает за счет дополнительного стягивания неподеленной пары электронов (р-электронов) атома кислорода ОН-группы. Вследствие такого смещения электронной плотности связь О—Н в гид-роксигруппе ослабляется, и атом водорода легко отщепляется в виде иона Н-. Поэтому именно гидроксигруппа участвует почти во всех реакциях: она или замещается, или диссоциирует по кислотному типу. В отличие от альдегидов, для карбоксильной группы не характерна карбонильная активность. Это объясняется электронным строением карбоксилат-иона:
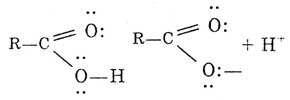
В карбоксилат-ионе происходит перераспределение электронной плотности между двумя атомами кислорода и углеродом. В результате двойная связь практически отсутствует в растворах кислот:
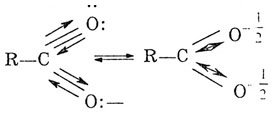
Так как влияние атомов взаимно, карбоксильная группа оказывает влияние на радикал. В результате этого атомы водорода соседнего с функциональной группой отличаются большей подвижностью от других атомов водорода радикала и могут замещаться.
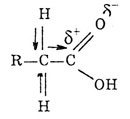
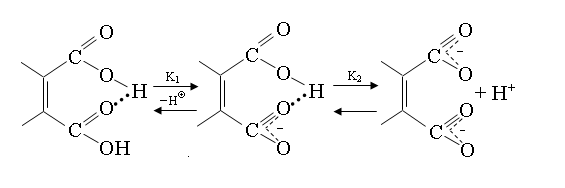
Водородные связи в карбон. к-тахю Карбоновые кислоты, как и спирты, могут участвовать в образовании Н-связей как в роли Н-доноров, так и Н-акцепторов. В первом случае кислотность снижается, во втором возрастает. Это ярко проявляется при ионизации двухосновных кислот: первая константа диссоциации (K1) аномально велика, а вторая (K2) аномально мала. Для объяснения наблюдаемых экспериментальных результатов кроме электронных эффектов большая роль придается вкладу Н-связей. В исходной структуре Н-связь сильно активирует карбоксильную группу, выступающую в роли Н-акцептора. В образовавшемся на первой стадии диссоциации моноанионе образуется прочная внутримолекулярная Н-связь, резко снижающая кислотность второго карбоксила:
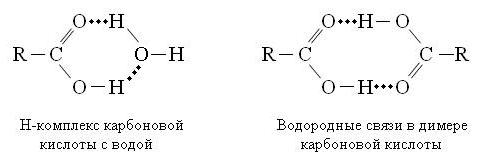
Для карбоновых кислот характерно образование Н-комплексов и ассоциатов псевдоциклической структуры:
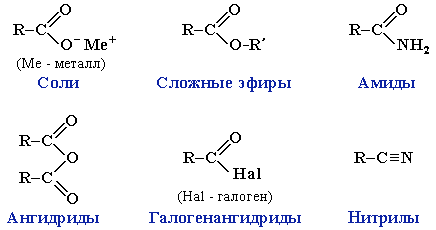
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
билет 9. Оксикислоты (оксикарбоновые кислоты, гидрокискарбоновые кислоты) — карбоновые кислоты, в которых одновременно содержатся карбоксильная и гидроксильная группы, например молочная кислота: СН3-СН(ОН)-СООН. Оксикислоты проявляют все свойства, характерные для кислот (диссоциация, образование солей, сложных эфиров и т. д.), и свойства, характерные для спиртов (окисление, образование простых эфиров и т. д.). Таутомери́я (от греч. ταύτίς — тот же самый и μέρος — мера) — явление обратимой изомерии, при которой два или более изомера легко переходят друг в друга. При этом устанавливается таутомерное равновесие, и вещество одновременно содержит молекулы всех изомеров (таутомеров) в определённом соотношении. Чаще всего при таутомеризации происходит перемещение атомов водорода от одного атома в молекуле к другому и обратно в одном и том же соединении. Классическим примером является ацетоуксусный эфир, представлющий собой равновесную смесь этилового эфира ацетоуксусной (I) и оксикротоновой кислот (II).
Таутомерия сильно проявляется для целого круга веществ, производных циановодорода. Так уже сама синильная кислота существует в двух таутомерных формах: 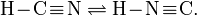
ЛАКТИДЫ, циклич. сложные эфиры a-гидроксикарбоновых к-т, содержащие две и более группировки —С(О)—О. Называют их как гетероциклич. соед. или в тривиальном назв. гидроксикислоты окончание преобразуют в окончание "ид". Умножающий префикс ("ди", "три" и т.д.) указывает на число молекул к-ты, образующих лактид. Простейшие и наиб. изученные лактиды - производные гликолевой к-ты (дигликолиды) общей ф-лы I (см. также табл.). Для этих соед. часто употребляют традиционные назв. без умножающих префиксов, напр. гликолид (в ф-лe I R-R'''=Н) и лактид (I; R=R''=СН3 и R'=R'''= Н). Известны также лактиды ароматич. и алициклич. к-т, напр. трисалицилид (ф-ла II) с т. пл. 199 oС. ИК спектры лактидов имеют характеристич. полосы в области 1670-1720 см-1 (С=О).
Лактам — циклический амид. Количество атомов в цикле может быть указано с помощью префиксов, например β-лактам (4-членный), γ-лактам (5-членный), δ-лактам (6-членный цикл). Также у многих лактамов есть исторически сложившиеся тривиальные названия, например γ-лактам — пирролидон, ε-лактам — капролактам.
Лактоны — внутренние циклические сложные эфиры, содержащие группировку —COO— в кольце: 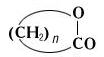
 2018-01-21
2018-01-21 2699
2699
