Все органические соединения подразделяют на следующие основные ряды:
I. Ациклические соединения — с открытой цепью углеродных атомов (их называют также алифатическими соединениями, или соединениями жирного ряда):
1. Предельные (насыщенные).
2. Непредельные (ненасыщенные).
II. Циклические соединения — с замкнутой в кольцо цепью атомов.
1. Карбоциклические (изоциклические),— в кольцевую систему которых входят только углеродные атомы:
а) алициклические (предельные и непредельные), б) ароматические.
2. Гетероциклические соединения — в их кольцевую систему, кроме углеродных атомов, входят атомы других элементов — гетероатомы (кислород, азот, сера и т. д.).
В рядах ациклических и карбоциклических соединений основными классами являются углеводороды.
.В предельных (насыщенных) углеводородах атомы углерода соединены друг с другом простыми (ординарными) связями С—С. В непредельных (ненасыщенных) углеводородах имеются одна или несколько пар углеродных атомов, соединенных кратными — двойными С = С или тройными С ≡ С связями.
Углеводороды с двойными или тройными связями могут быть образованы путем отнятия 2, 4, 6 и более атомов водорода от пар смежных углеродных атомов в предельных углеводородах; при этом получаются непредельные углеводороды, содержащие соответственно двойную, тройную, две двойные и т. д. связи. При отнятии же двух и более атомов водорода от несмежных углеродных атомов из предельных ациклических углеводородов могут быть получены циклические углеводороды. Таким образом, все другие углеводороды можно рассматривать как производные предельных ациклических углеводородов.
Несколько кратных связей могут иметь различное взаимное расположение в углеродной цепи. Например, различают кумулированные С = С = С, сопряженные (или конъюгированные) С = С—С = С и изолированные (или уединенные) С = С—(СН2)п—С = С двойные связи.
Углеводороды различных классов образуют так называемые гомологические ряды, в которых каждый последующий углеводород отличается от предыдущего члена ряда на гомологическую разность СН2. Состав любого члена гомологического ряда выражается общей для данного ряда эмпирической формулой. Например, состав ациклических предельных углеводородов может быть представлен формулой СnН2n+2, непредельных — с одной двойной связью CnH2n, — с одной тройной или с двумя двойными связями СnН2n – 2 и т. д.
При замещении в углеводородах того или иного гомологического ряда одного или нескольких атомов водорода отдельными атомами или группами (например, галогенами, группами —NO2, —ОН, —NH2 и т. д.) образуются гомологические ряды, соответственно, галогенпроизводных, нитросоединений, спиртов, аминов и т. д. Таким образом, все другие классы органических соединений того или иного ряда являются производными углеводородов.
Ниже дана краткая характеристика различных номенклатурных систем.
Тривиальные названия не вытекают из каких-либо единых систематических принципов номенклатуры; они не выражают строения соединения и обычно отражают историю, происхождение веществ, выделение их из природных продуктов, путь синтеза и т. п. (например, рудничный газ, муравьиная кислота, винный спирт, бензол, ванилин, стрептоцид). Многие соединения названы по имени ученого, открывшего их (кетон Михлера, углеводород Чичибабина и т. п.). Однако и некоторые тривиальные названия приведены в известную систему. Так, в ряду метана все названия углеводородов, начиная от C5, являются систематическими — корни их производятся от греческих числительных, и все они имеют общее окончание -ан (пентан, гексан, гептан) и т. д.; названия же первых четырех представителей этого ряда (метан, этан, пропан, бутан) — тривиальные, так как корни их не образованы по какой-либо системе, однако и эти названия имеют общее для ряда метана окончание -ан. Такие названия по номенклатуре IUPAC обозначаются как полутривиальные или полусистематические (semi-trivial и semi-sistematic).
Рациональная и другие упомянутые номенклатуры построены на принципах научной систематики органических соединений: название соединения должно отражать его химическое строение.
По рациональной номенклатуре за основу наименования органического соединения обычно принимают название наиболее простого (чаще всего первого) члена данного гомологического ряда. Все остальные соединения рассматривают как производные этого простейшего гомолога, образованные замещением в нем атомов водорода углеводородными или иными радикалами, атомами или атомными группами.
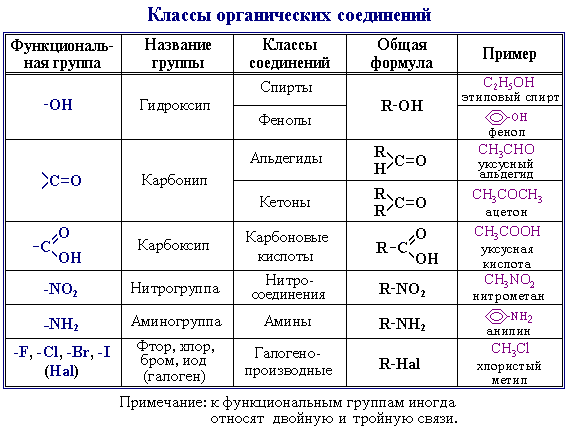
Билет 2. Функциональная группа — структурный фрагмент органической молекулы (некоторая группа атомов), определяющий её химические свойства. Функциональные группы определяют класс органических соединений.
Функциональные группы, входящие в состав различных молекул обычно ведут себя одинаково в одной и той же химической реакции, однако их химическая активность будет различной.
Изомеры – это вещества, которые имеют одинаковый состав и одинаковую молярную массу, но различное строение молекул, а потому обладающие разными свойствами. Виды изомерии на рисунке. Номенклату́ра ИЮПА́К — это система наименований химических соединений и описания науки химии в целом. Она развивается и поддерживается в актуальном состоянии Международным союзом теоретической и прикладной химии — ИЮПАК (IUPAC). В Голубой книге издания 1993 года главная задача номенклатуры определена как «идентификация химического вещества посредством письменной или устной речи». Основной принцип при создании научной номенклатуры — однозначное соответствие названия структуре соединения. Система принципов и правил такой номенклатуры носит название «систематическая номенклатура». В номенклатуре ИЮПАК подчёркивается, что правила систематической номенклатуры не обязательно дают уникальное название для каждого соединения (т.е. могут существовать разные названия одного вещества, не противоречащие правилам ИЮПАК), но эти названия всегда будут однозначными (одному названию будет соответствовать только одно вещество). Противоположностью систематических названий являются традиционные, полусистематические или тривиальные названия, которые широко используются для распространённых соединений (например, «уксусная кислота», «глицин» и т.п.). Номенклатура ИЮПАК допускает использование таких названий, особенно в устной речи, однако постепенно стремится сократить их число.
Билет 3. Алка́ны (также насыщенные углеводороды, парафины, алифатические соединения) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и образующие гомологический ряд с общей формулой CnH2n+2. Алканы являются насыщенными углеводородами и содержат максимально возможное число атомов водорода. Каждый атом углерода в молекулах алканов находится в состоянии sp3-гибридизации — все 4 гибридные орбитали атома С равны по форме и энергии, 4 электронных облака направлены в вершины тетраэдра под углами 109°28'. За счёт одинарных связей между атомами С возможно свободное вращение вокруг углеродной связи. Тип углеродной связи — σ-связи, связи малополярны и плохо поляризуемы. Длина углеродной связи — 0,154 нм. Алканы имеют низкую химическую активность. Это объясняется тем, что единичные связи C—H и C—C относительно прочны и их сложно разрушить. Поскольку углеродные связи неполярны, а связи С—Н малополярны, оба вида связей малополяризуемы и относятся к σ-виду, их разрыв наиболее вероятен по гомолитическому механизму, то есть с образованием радикалов.
Галогенирование — это одна из реакций замещения. В первую очередь галогенируется наименее гидрированый атом углерода (третичный атом, затем вторичный, первичные атомы галогенируются в последнюю очередь). Галогенирование алканов проходит поэтапно — за один этап замещается не более одного атома водорода:
CH4 + Cl2 → CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
Основным химическим свойством предельных углеводородов, определяющих их использование в качестве топлива, является реакция горения. Пример: CH4 + 2O2 → CO2 + 2H2O + Q.
Значение Q достигает 46 000 — 50 000 кДж/кг.
В случае нехватки кислорода вместо углекислого газа получается угарный газ или уголь (в зависимости от концентрации кислорода).
В общем виде реакцию горения алканов можно записать следующим образом:
СnН2n+2 +(1,5n+0,5)O2 → nCO2 + (n+1)H2O.
Крекинг
При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав и соотношение которых зависят от температуры и времени реакции. При пиролизе происходит расщепление углерод-углеродных связей с образованием алкильных радикалов.
Нитрование:
Реакция Коновалова
Алканы реагируют с 10 % раствором азотной кислоты или оксидом азота NO2 в газовой фазе при температуре 140 °C и небольшом давлении с образованием нитропроизводных.
RH + HNO3 → RNO2 + H2O.
Все имеющиеся данные указывают на свободнорадикальный механизм. В результате реакции образуются смеси продуктов.
Получение
Главным источником алканов (а также других углеводородов) являются нефть и природный газ, которые обычно встречаются совместно.
Восстановление галогенпроизводных алканов:
При каталитическом гидрировании в присутствии палладия галогеналканы превращаются в алканы[5]:
R—CH2Cl + H2 → R—CH3 + HCl
Восстановление иодалканов происходит при нагревании последних с иодоводородной кислотой:
R—CH2I + HI → R—CH3 + I2
Гидрирование непредельных углеводородов
Из алкенов
CnH2n + H2 → CnH2n+2
Из алкинов
CnH2n-2 + 2H2 → CnH2n+2
Реакция Вюрца
2R—Br + 2Na = R—R + 2NaBr
Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинам атом водорода присоединяется к наиболее гидрогенизированному (гидрированному) атому углерода (в месте разрыва двойной связи). Названо по имени его автора В. В. Марковникова и сформулировано им в 1869 году.
Правило Зайцева. Реакция элиминирования (отщепления) подчиняется правилу Зайцева, если в её ходе преимущественно образуются более замещённые при двойной связи алкены (они же — наиболее устойчивые, обладающие более низкой энергией). Более старая формулировка правила гласит: отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода.
Билет 4. ГАЛОГЕНОПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ (галогенсодержащие углеводороды) - углеводороды, в молекулах которых один или несколько атомов водорода замещены на атомы галогена. Сырье в промышленном органическом синтезе, растворители, хладоны. Номенклатура, изомерия. По рациональной номенклатуре название галогенопроизводных образуют из названия углеводородного радикала и галогена, в необходимых случаях указывают положение последнего. 
По систематической номенклатуре положение атома галогена указывают цифрой, которая вместе с его названием располагается перед названием радикала. Нумерацию атомов углерода начинают с того конца молекулы, к которому ближе расположен атом галогена. Способы получения галогенопроизводных
3)Замещение атомов водорода в алканах на галоген 
Реакции протекают только при повышенных температурах или облучении УФ-светом по
гомолитическому (радикальному) механизму. Замещение происходит у третичного атома углерода.
 2018-01-21
2018-01-21 974
974







