Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
Kг=K/Kд(слаб. электролита)
Активность и ионная сила растворов. Связь между коэффициентом активности и ионной силой раствора.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учётом различных взаимодействий между ними в растворе. a=f*c
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. μ=  ∑Ci*Zi2
∑Ci*Zi2
При μ≤0,01 f рассчитывают по уравнению Дебая-Хюккеля: lgf=-0,509Z2 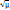
При высоких ионных силах f рассчитывается по формуле Дэвиса:
lgf=Z2[0,2 μ - 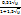 ]
]
 2018-01-21
2018-01-21 525
525








