Электролитическая диссоциация – распад молекулы на ионы под действием полярных молекул растворителя. Э.д. подразумевает ионную проводимость раствора.
Степень э.д. – величина, равная отношению числа распавшихся на ионы молекул к общему числу молекул электролита.
α=(n/N)*100% cдис=α*cобщ
По значению α электролиты классифицируются следующим образом:
Слабые – α<3%, присутствуют как ионы, так и молекулы
Средней силы – 3%< α<30%, присутствуют как ионы, так и молекулы
Сильные – α >30%, в растворе только ионы.
Если α=1 – протекает процесс полной э.д.
Если α=0 – процесс не протекает
Константа диссоциации — вид константы равновесия, которая показывает склонность большого объекта диссоциировать (разделяться) обратимым образом на маленькие объекты, как например когда комплекс распадается на составляющие молекулы, или когда соль разделяется в водном растворе на ионы.
Kд=ПКИ(эл.-та)/с(мол. эл.-та)
ПКИ – произведение концентраций ионов
К.д. имеет смысл только для растворов слабых электролитов
Закон разбавления Оствальда: с уменьшением концентрации электролитов степень э.д. увеличивается.
Kд=с* α2 => α= 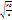
 2018-01-21
2018-01-21 572
572








