Раствори́мость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.

Факторы, влияющие на растворимость
Природа растворяемого вещ-ва
Температура
Давление
15. Способы выражения содержания растворимого вещества в растворе
В химической практике применяются растворы с различным содержанием растворенного вещества. Для таких растворов используют следующие способы выражения концентрации растворенного вещества: массовая доля и мольная доля растворенного вещества, молярная и моляльная концентрации, молярная концентрация эквивалента.
16. Свойства разбавленных растворов неэлектролитов. Законы Рауля.
Понижение давления пара растворителя над раствором пропорционально мольной доле растворенного вещества. Суть явления с физической точки зрения - уменьшение поверхности испарения. С химической точки зрения - уменьшение количества молекул растворителя за счет сольватации.
 - I закон Рауля
- I закон Рауля
Повышение Т кипения раствора - понижение давления пара растворителя приводит к необходимости увеличения температуры, при которой pпара=pатм (кипение).
Понижение температуры замерзания раствора (pпара над ж.=pпара над тв.).
Повышение Т кипения и понижение Т замерзания раствора не зависят от природы растворенного вещества, а зависят только от количества растворенных частиц (моляльной концентрации) -II закон Рауля.
DТкип. = Еm, Е - эбулиоскопическая константа
DТзам. = Кm, К - криоскопическая константа
Е и К - характеристики растворителя.
17. Явление осмоса, осмотическое давление. Закон Вант-Гоффа
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением.
По Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворенное вещество, будучи переведенным в газообразное состояние в том же объеме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде
|
18. Растворы электролитов, изотонический коэффициент. Теория электролитической диссоциации. Константа диссоциации.
Законы Рауля и принцип Вант-Гоффа не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток – растворов электролитов. Для учета этих отклонений Вант-Гофф внес в уравнение (35) для растворов электролитов поправку – изотонический коэффициент:
 (37)
(37)
Аналогичная поправка вносится в законы Рауля и изотонический коэффициент определяется следующим образом:
 (38)
(38)
Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает и стремится к некоторому целочисленному значению. Обобщая экспериментальные данные, Вант-Гофф пришел к выводу, что растворы электролитов всегда ведут себя так, будто они содержат больше частиц растворенного вещества, чем следует из аналитической концентрации: повышение температуры кипения, понижение температуры замерзания и осмотическое давление для них всегда больше, чем вычисленные. Для объяснения особенностей свойств растворов электролитов С.Аррениус предложил теорию электролитической диссоциации, основывающуюся на следующих постулатах:
1. Электролиты в растворах распадаются на ионы – диссоциируют;
2. Диссоциация является обратимым равновесным процессом;
3. Силы взаимодействия ионов с молекулами растворителя и друг с другом малы (т.е. растворы являются идеальными).
Диссоциация электролитов в растворе происходит под действием полярных молекул растворителя; наличие ионов в растворе предопределяет его электропроводность. Для оценки полноты диссоциации в теории электролитической диссоциации вводится понятие степень диссоциации α, которая равна отношению числа молекул n, распавшихся на ионы, к общему числу молекул растворённого вещества N:
 (39)
(39)
Величина степени диссоциации зависит от природы растворителя и растворенного вещества, концентрации раствора и температуры. По величине степени диссоциации электролиты подразделяются на три группы: сильные (α ≥ 0.7), средней силы (0.3 < α < 0.7) и слабые (α ≤ 0.3). К сильным электролитам относятся почти все соли (кроме Рb(СН3СОО)2, НgСl2, СdСl2), большинство неорганических кислот и щелочей; к слабым – все органические кислоты, вода, NН4ОН, Н2S и т.д. Электролитами средней силы являются некоторые неорганические кислоты: НF, НСN, Н3PO4.
Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:

константа диссоциации выразится следующим соотношением:
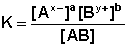 (40)
(40)
Для бинарного (распадающегося на два иона) электролита выражение (40) можно переписать в следующем виде:
 (41)
(41)
Поскольку концентрация каждого иона для бинарного электролита равна произведению степени диссоциации α на общую концентрацию электролита С, выражение (41) в этом случае можно записать следующим образом:
 (42)
(42)
Для растворов слабых электролитов можно считать, что (1 – α) приближённо равно 1. Тогда получаем:
 (43)
(43)  (44)
(44)
19. Степень диссоциации, сильные и слабые электролиты.
Электролитическая диссоциация относится к обратимым процессам, поэтому в растворах электролитов наряду с распадом соединений на ионы имеет место и обратный процесс – их соединение.
Распад соединений на ионы обозначают стрелкой →
Обратный процесс (соединение) обозначают стрелкой ←
Например:
HNO2 ⇄ H+ + NO2–
Степень диссоциации (α) – это отношение числа продиссоциировавших (распавшихся) на ионы молекул (n) к общему числу растворенных молекул (N):
n
α = —
N
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе.
Поэтому в уравнениях диссоциации сильных электролитов ставят знак равенства (=).
К сильным электролитам относятся:
- растворимые соли;
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;
- основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄).
К слабым электролитам относятся:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др.
20. Реакции в растворах электролитов.
21.Диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
Чистая вода, хоть и плохо (по сравнению с растворами электролитов), но может проводить электрический ток. Это вызвано способностью молекулы воды распадаться (диссоциировать) на два иона которые и являются проводниками электрического тока в чистой воде (ниже под диссоциацией подразумевается электролитическая диссоциация - распад на ионы):
H2O ↔ H+ + OH-
K = [H+] • [HO-]/55,6 моль/л
1,8•10-16 • 55,6 моль/л = [H+] • [HO-]
10-14 = [H+] • [HO-]
Для удобства, концентрации [H+] и [HO-] выражают в виде водородного показателя pH и гидроксильного показателя pOH. pH и pOH - это отрицательные десятичные логарифмы концентраций [H+] и [HO-] (правильнее использовать не концентрацию, а активность) соответственно:
pH = -lg[H+]
pOH = -lg[OH-]
Вопрос 22
Гидро́лиз — Это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.

Вопрос 23
Овр — это реакции, в результате которых происходит изменение степеней окисления атомов химических элементов или ионов, образующих реагирующие вещества
Сте́пень окисле́ния — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций
Как определить степень окисления?
Электроотрицательность – это способность атомов притягивать к себе электроны других элементов.
Степень окисления указывается над элементом: Br20, Na0, O+2F2-1, K+Cl- и т.д.
Она может быть отрицательной и положительной.
- Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю.
- Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н2О2, где она равна -1 и соединения с фтором – O+2F2-1, O2+1F2-1).
- Степень окисления простого одноатомного иона равна его заряду: Na+, Ca+2.
- Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды - Na+H- и соединения типа C+4H4-1).
- В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H+F-, Cu+Br-, Ca+2(NO3)- и т.д.
 2018-01-21
2018-01-21 2895
2895

