Энтропия – это мера неупорядоченности состояния системы; стремление частиц (молекул, ионов, атомов) к хаотическому движению, а системы – к переходу от более упорядоченного состояния к менее упорядоченному. Энтропия возрастает с увеличением движения частиц при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п. Процессы, связанные с упорядоченностью системы (конденсация, кристаллизация, сжатие, упрочнение связей, полимеризация), сопровождаются уменьшением энтропии. Измеряется энтропия в Дж/моль*К.
Изменение энтропии системы в результате протекания химической реакции (?S) (энтропия реакции) равно сумме энтропий продуктов реакции за вычетом суммы энтропий исходных веществ с учетом стехиометрических коэффициентов. Изменение энтропии в результате протекания химической реакции aA + bB = сС + dD:
| Δ G = Δ H – T Δ S |
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (Δ H), и энтропийным T Δ S, обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса(G, кДж):
Вопрос 9. Энергия Гиббса и направление химических реакций.
В химических процессах одновременно действуют два противоположных фактора — энтропийный (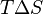 ) и энтальпийный (
) и энтальпийный (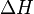 ). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса (
). Суммарный эффект этих противоположных факторов в процессах, протекающих при постоянном давлении и температуре, определяет изменение энергии Гиббса ( ):
):
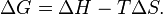
Из этого выражения следует, что 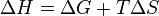 , то есть некотороеколичествотеплотырасходуется на увеличение энтропии (), эта часть энергии потеряна для совершения полезнойработы(рассеивается в окружающую среду в виде тепла), её часто называютсвязанной энергией. Другая часть теплоты (
, то есть некотороеколичествотеплотырасходуется на увеличение энтропии (), эта часть энергии потеряна для совершения полезнойработы(рассеивается в окружающую среду в виде тепла), её часто называютсвязанной энергией. Другая часть теплоты (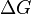 ) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
) может быть использована для совершения работы, поэтому энергию Гиббса часто называют также свободной энергией.
Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса. При 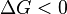 процесс может протекать, при
процесс может протекать, при 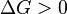 процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же
процесс протекать не может (иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может). Если же 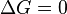 , то система находится в состояниихимического равновесия.
, то система находится в состояниихимического равновесия.
Свободная энергия Гиббса (или просто энергия Гиббса, или потенциал Гиббса, или термодинамическийпотенциал в узком смысле) — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакции; этотермодинамическийпотенциалследующего вида:
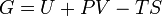
Энергию Гиббса можно понимать как полную химическуюэнергиюсистемы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамикеихимии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпиисистемы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста еёэнтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж)
Классическим определением энергии Гиббса является выражение
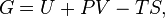
где 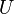 —внутренняя энергия,
—внутренняя энергия, 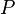 —давление,
—давление, 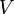 —объём,
—объём, 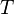 — абсолютнаятемпература,
— абсолютнаятемпература, 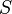 —энтропия.
—энтропия.
Дифференциалэнергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — черездавлениеpитемпературуT:
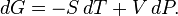
Для системы с переменным числом частиц этот дифференциал записывается так:
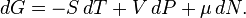
Здесь 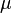 —химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
—химический потенциал, который можно определить как энергию, которую необходимо затратить, чтобы добавить в систему ещё одну частицу.
 2018-01-21
2018-01-21 3747
3747
