
Анодная защита от коррозии
Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах.
При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии.
Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла.
Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией.
Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду.
При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле.
Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону.
Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта.
Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области.
Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина.
Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы.
Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально.
Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием:
- все сварные швы должны быть выполнены качественно;
- в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние;
- количество воздушных карманов и щелей должно быть минимальным;
- на конструкции не должно присутствовать заклепочных соединений;
- в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе.
Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму.
Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников.
Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты
Изменение свойств коррозионной среды. Здесь применяется специальная обработка электролита или среды, в которой находится защищаемая конструкция. Вода, поступающая в котельные установки, подвергается деаэрации – удалению растворённого воздуха. Введение в электролит ингибиторов, их адсорбция на защищаемой детали резко замедляет процесс коррозии.
В последние годы широко применяют летучие парофазные игибиторы. Их используют для защиты машин, аппаратов и других металлических изделий во время их эксплуатации в воздушной атмосфере, при перевозке и хранении. Летучие ингибиторы вводятся в контейнеры, в упаковочные материалы или помещаются в непосредственной близости от рабочего агрегата. Благодаря достаточно высокому давлению паров летучие ингибиторы достигают границы раздела металл – воздух и растворяются в плёнке влаги, покрывающей металл. Далее они адсорбируются на поверхности металла.
РЕШЕНИЕ
Стандартные электродные потенциалы хрома и никеля:
Cr3+ + 3e → Cr, Eº= -0.71 В Ni2+ + e → Ni, Eº= -0.25 В
Сравнивая электродные потенциалы, получаем, что хром более электроотрицателен, чем никель. Поэтому в возможном коррозионном процессе никель будет является анодом, а хром — катодом:
A (-)Cr|| Ni (+)K
Т.е. пока никель контактирует с хромом, коррозии будет подвергаться преимущественно хром.
Врастворе HCl деполяризующим элементом выступают ионы водорода Н+. Потенциал водородного электрода и катодная реакция его восстановления в кислой среде:
2H+ + 2e → H2
Термодинамическую возможность коррозии оцениваем сравнением стандартных потенциалов каждого из металлов с потенциалом водородного электродов. Если потенциал металла меньше потенциала водородного электрода, то коррозия термодинамически возможна и наоборот.
Так как потенциалы хрома и никеля меньше потенциалаводородного электрода(-0,71 В <-0,25 В < 0,00 В), то термодинамически то термодинамически в соляной кислотевозможна коррозия обоих металлов с водородным деполяризатором. Ноиз-за образования гальванопары преимущественно корродировать будет хром:
Анодная реакция: Cr0 → Cr3+ + 3e |3| - окисление
Катодная реакция: 2H+ + 2e → H2 |2| восстановление
Суммарная молекулярная реакция:
2Cr+ 6H+ → 2Cr3+ + 3H2
Схема никель-хромовой гальванопары в кислой среде:
Анод (-) Cr| H2O, H+ | Ni (+) Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – ионыхрома(III).
Термодинамическую возможность коррозии оценивают путем сравнения стандартных потенциалов каждого из металлов с потенциалом кислородного электрода:
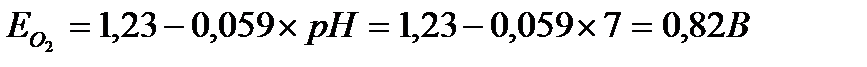 O2 + 2H2O + 4e → 4OH-
O2 + 2H2O + 4e → 4OH-
Так как потенциалы хрома и никеля меньше потенциала кислородного электрода(-0,71В <-0,25 В < 0,82 В), то термодинамически возможна коррозия обоих металлов с кислородным деполяризатором. Ноиз-за образования гальванопары преимущественно должен был бы корродировать хром. В реальных условиях коррозия хрома во влажной среде насыщенной кислородом практически не происходит, так как хром в этих условиях покрыт плотной оксидной пленкой, которая препятствует его дальнейшему окислению. Термодинамически же, без учета оксидной пленки, хром мог бы во влажной почве корродировать, при этом протекали бы следующие процессы:
Анодная реакция: Cr0 → Cr3+ + 3e |3| - окисление
Катодная реакция: O2 + 2H2O + 4e → 4OH- |4| - восстановление
Суммарная молекулярная реакция:
4Cr + 3O2 + 6H2O →4Cr(OH)4
Схема никель-хромовойгальванопары в среде Н2О + О2:
Анод (-) Cr| H2O, O2 | Ni (+) Катод
Движение электронов во внешней цепи – от анода к катоду, направление электрического тока – противоположное.
В результате продукт коррозии – гидроксидхрома(III).
 2018-01-21
2018-01-21 453
453







