
 радиус,усилив.Ме св-ва,возраст. основн-ть оксидов и гидроксид.,падает кислотность;
радиус,усилив.Ме св-ва,возраст. основн-ть оксидов и гидроксид.,падает кислотность;  растет.устойчив.к высш.ст.ок-я,ослаб.Ме св-ва,усил.амфотерность,уменьш.восст-й хар-р. Физ.св-ва:Серебристо-бел.цв.,сильные восс-ли.,сред.тугоплавк-ти. tплавл.(Be)=1; tплавл.(Mg)=650
растет.устойчив.к высш.ст.ок-я,ослаб.Ме св-ва,усил.амфотерность,уменьш.восст-й хар-р. Физ.св-ва:Серебристо-бел.цв.,сильные восс-ли.,сред.тугоплавк-ти. tплавл.(Be)=1; tплавл.(Mg)=650  . В природе оч.распылены,и содерж.только в виде соед-й. Получают электролизом расплава соед-й. I.магнезит MgC
. В природе оч.распылены,и содерж.только в виде соед-й. Получают электролизом расплава соед-й. I.магнезит MgC  MgO+CO2 жженая «магнезия» неакт.ф-ма исп-ся в огнеупорах.II.MgO
MgO+CO2 жженая «магнезия» неакт.ф-ма исп-ся в огнеупорах.II.MgO  MgO+CO2 каустический магнезит хим.акт.ф-ма,оч.активен.,исп-ся в огнеупорах,для получ.магнезиального вяж.вещ-ва MgO+
MgO+CO2 каустический магнезит хим.акт.ф-ма,оч.активен.,исп-ся в огнеупорах,для получ.магнезиального вяж.вещ-ва MgO+  кисл.среда,если добавить древесн.опилки стружки,получим ксилолит.III.MgCO3
кисл.среда,если добавить древесн.опилки стружки,получим ксилолит.III.MgCO3  MgO+CO2 высокообжиг.переклаз Неакт.ф-ма,примен.для изготовл.огнеупорн.мат-в.Возможен обжиг доломита:
MgO+CO2 высокообжиг.переклаз Неакт.ф-ма,примен.для изготовл.огнеупорн.мат-в.Возможен обжиг доломита:  CaO+MgO+2CO2
CaO+MgO+2CO2  каустич.доломит.IV.Расплав MgO
каустич.доломит.IV.Расплав MgO  MgOкристаллы
MgOкристаллы
19. Ca серебристого цвета, сильный вост-тель, ср.тугоплавкости tпл=845 С. В природе очень распылен и созд. В виде соединений CaCl2. В природе встреч. CaCO3 *MgCo3- доломит, CaF2, CaSO4*2H2O –гипс каменный, CaSO4*H2O – алебастр, CaSO4*0.5H2O-строительный гипс.
Очень активный Me6: 1)  2) с водородом
2) с водородом  3) c водой
3) c водой  4) c NaOH
4) c NaOH 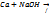 реакция не идет. Действие кислот: 1)
реакция не идет. Действие кислот: 1) 
2) 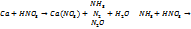
 Св-ва соединений оксидов и гидрооксидов:
Св-ва соединений оксидов и гидрооксидов:  р-я не идет. Примечание: соединения с оксидами Ca одно из состояний цем. Камня. Кальций в строительном деле.
р-я не идет. Примечание: соединения с оксидами Ca одно из состояний цем. Камня. Кальций в строительном деле.  для получения огнепупорн. Материалов. В процессе получения вяжущего.
для получения огнепупорн. Материалов. В процессе получения вяжущего. 



20) Al серебрист. Цвета, сильный востановитель, ср. тугоплавкости.  в природе очень распылен и встречается только в виде соедин.
в природе очень распылен и встречается только в виде соедин. 
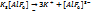


Дополнительн процесс. 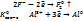
В природе созд. 

t wx:val="Cambria Math"/><w:i/><w:noProof/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>O</m:t></m:r><m:r><w:rPr><w:rFonts w:ascii="Cambria Math" w:h-ansi="Times New Roman"/><wx:font wx:val="Cambria Math"/><w:i/><w:noProof/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t> </m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">  очень активный Me: 1)
очень активный Me: 1) 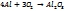 2) с водородом
2) с водородом 
3) с водой  Чистый Al со щелочью не реагирует, но Al побывавш на воздухе реагирует с водным р-м щелочи и реакция идет в 2-е стадии.
Чистый Al со щелочью не реагирует, но Al побывавш на воздухе реагирует с водным р-м щелочи и реакция идет в 2-е стадии.
1. 
2. 
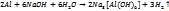
Действие кислот.1)  2)
2) 
Al- амфотерен, амфотерны и его оксиды и гидрооксиды.Св-ва соединений оксид. И гидрооксид.
1) 
2) s w:ascii="Cambria Math" w:h-ansi="Cambria Math"/><wx:font wx:val="Cambria Math"/><w:i/><w:noProof/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>O</m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">  Амфотерность.
Амфотерность.
1) 
2)  - в водном р-ре. Применение. Примен. Как конструкц. Me для строительных сооружений в сейсмоопасных р-х. Газобетон- порошок Al вводят в цементный р-р.
- в водном р-ре. Применение. Примен. Как конструкц. Me для строительных сооружений в сейсмоопасных р-х. Газобетон- порошок Al вводят в цементный р-р. 
21) углерод. Абсолютно нерастворимых в-в нет. Пр- произв. Растворимости. Смысл Пр. показывает сколько ионов скопилось, насколько в осадке полно связаны ионы.




Нахождение в природе. Алмаз (тв.); Графит (пласт); карбит (полимерн. Соед.).Аморфный уголь. Фулерен. Хим. Св-ва. 1) 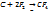
22.Хим.св-ва кремния: 1)Si + 2  àSi
àSi  ; 2)Si + 2KOH +
; 2)Si + 2KOH +  O à
O à  +2
+2  ;
;
3)Si + 4HF à Si  +2
+2  ; Si
; Si  +2HFà
+2HFà  ;
;
Ca + Sià  ; Si +
; Si +  àSi
àSi  ;
;
Si  +CàSiC (карборунд, реак-я идёт при 2000 ℃):
+CàSiC (карборунд, реак-я идёт при 2000 ℃):
а)Si  +CàSi+C
+CàSi+C  ; б)Si+CàSiC;
; б)Si+CàSiC;
Формы:1. Si  - кварц; чистый горный хрусталь;
- кварц; чистый горный хрусталь;
2.. Si  *
*  O – опал – драг., белый. Si
O – опал – драг., белый. Si  – силикогель;
– силикогель;
3. Si  - землистый; трепел, диатомит, используется как добавка к ценментам.
- землистый; трепел, диатомит, используется как добавка к ценментам.


Этим обусловлена прочность старинных кладок. Гидротермальная обработка: 1)Паровая; 2)Автоклавная (174℃; P=9 атм;  O); 4.Высокодисперсная Si
O); 4.Высокодисперсная Si  : Si+2Mgà
: Si+2Mgà  (600℃);
(600℃);  +4HClà2Mg
+4HClà2Mg  + Si
+ Si  (силан); Si
(силан); Si  +2
+2  à
à  + 2
+ 2  O; Si
O; Si  – пылит). Кремневые к-ты:
– пылит). Кремневые к-ты:  - кислотный оксид; мономерные – растворимые.
- кислотный оксид; мономерные – растворимые.  – орто;
– орто;  - мета; Полимерные к-ты:
- мета; Полимерные к-ты:  O+
O+  ; Кремниевые кислоты слабее угольной: 1)
; Кремниевые кислоты слабее угольной: 1)  à
à  +t wx:val="Cambria Math"/><w:i/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>3</m:t></m:r></m:sub></m:sSub></m:e><m:sup><m:r><w:rPr><w:rFonts w:ascii="Times New Roman" w:h-ansi="Times New Roman"/><wx:font wx:val="Times New Roman"/><w:i/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>-</m:t></m:r></m:sup></m:sSup></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">
+t wx:val="Cambria Math"/><w:i/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>3</m:t></m:r></m:sub></m:sSub></m:e><m:sup><m:r><w:rPr><w:rFonts w:ascii="Times New Roman" w:h-ansi="Times New Roman"/><wx:font wx:val="Times New Roman"/><w:i/><w:sz w:val="12"/><w:sz-cs w:val="12"/></w:rPr><m:t>-</m:t></m:r></m:sup></m:sSup></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">  , Кд1= 2*
, Кд1= 2* 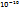 ; 2)
; 2)  +
+  , Кд2=1*
, Кд2=1*  ; В воде образуются коллоидные р-ры: золи. Тиксотропия: 1)
; В воде образуются коллоидные р-ры: золи. Тиксотропия: 1)  +HOHà
+HOHà  +NaOH; 2)
+NaOH; 2)  +HOHà
+HOHà  +NaOH;
+NaOH;
Золь ß/à гель - тиксотропия. Строение коллоидной частицы:. 
 .
.
(Все элементы подписать под основной формулой, весь хлам не писать):  - ядро;
- ядро;  - адсорбция;
- адсорбция;  -диффузия;
-диффузия; 
 ;
;
 - мицелла; Для достижения достижения нейтральности притягиваются противоионы; Мицелла – наименьшее кол-во в-ва коллоидного, способного к самостоятельному существованию в р-ре. Коагуляция à садиментация. Сорбция- концентрирование; поглащение газов, паров жидкими поглотителями. Десорбция – отдача сорбирующего в-ва; Сорбент – в-во на котором идёт сорбция; Сорбат – в-во которое сорбируется. Адсорбция – Удерживание поврехностью. Абсорбция – поглащение всем объёмом.(кислород в воде). Силикаты – соли кремниевых кислот. Природные: алюмосиликаты:
- мицелла; Для достижения достижения нейтральности притягиваются противоионы; Мицелла – наименьшее кол-во в-ва коллоидного, способного к самостоятельному существованию в р-ре. Коагуляция à садиментация. Сорбция- концентрирование; поглащение газов, паров жидкими поглотителями. Десорбция – отдача сорбирующего в-ва; Сорбент – в-во на котором идёт сорбция; Сорбат – в-во которое сорбируется. Адсорбция – Удерживание поврехностью. Абсорбция – поглащение всем объёмом.(кислород в воде). Силикаты – соли кремниевых кислот. Природные: алюмосиликаты:  O;
O;  à
à  *
*  O;
O;  à
à  O*
O*  ; Ca
; Ca  à CaO*
à CaO*  ; Растворимое (жидкое) стекло – силикатный клей:1
; Растворимое (жидкое) стекло – силикатный клей:1  +
+  à
à  + C
+ C  ; 2)NaOH +
; 2)NaOH +  à
à  +
+  O; 3)
O; 3)  +
+  +CO+
+CO+  ; (все 3 р-ии выше – сплавление) 1.Как связующее вещество в строительстве:
; (все 3 р-ии выше – сплавление) 1.Как связующее вещество в строительстве:  à
à  *
*  O (золь) à
O (золь) à  O ↓ 2.Укрепление грунта у фундамента; 3.Огнеупорные, кислотоупорные замазки в смеси с
O ↓ 2.Укрепление грунта у фундамента; 3.Огнеупорные, кислотоупорные замазки в смеси с  ; Различают фторсиликаты:
; Различают фторсиликаты:
Растворимые: флюаты( *6
*6  O; Ca
O; Ca  *2
*2  O;
O;  O. Нерастворимые:
O. Нерастворимые: 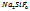 ;
;  1)
1)  + 2
+ 2  Oà
Oà  +2NaOH; 2)
+2NaOH; 2) 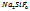 + 4NaOHà6NaF↓ +
+ 4NaOHà6NaF↓ +  ↓;
↓;
Флюатирование – закрепление поверхности строительных камней, как естественных так и искусственных.  *6
*6  O! Обработка бетона через 28 дней после заливки. Обмазывают 3-4 раза флюатом – раз в неделю.
O! Обработка бетона через 28 дней после заливки. Обмазывают 3-4 раза флюатом – раз в неделю.
 O (5-6mm за год)
O (5-6mm за год)
 Oà
Oà  ;
;
Mg  +2
+2  +n
+n  Oà
Oà 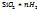 O ↓ +
O ↓ +  ↓+
↓+  ↓ + 2
↓ + 2  ;
;
 n
n  Oà3
Oà3 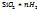 O↓ + 6
O↓ + 6  ↓ + 2
↓ + 2  ↓+ 6
↓+ 6 
Силикат кальция:
CaO+  à
à  (Сплавление);
(Сплавление);

I. 3CaO* 
II. 2CaO* 
III. 3CaO* 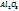
IV. 4CaO* 
1)3CaO*  + HOHà 2CaO*
+ HOHà 2CaO*  +
+  ; 2) 2CaO*
; 2) 2CaO*  +HOHà CaO*
+HOHà CaO*  +
+  3) CaO*
3) CaO* 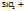
s w:val="12"/><w:lang w:val="EN-US"/></w:rPr><m:t>2</m:t></m:r></m:sub></m:sSub><m:r><m:rPr><m:sty m:val="p"/></m:rPr><w:rPr><w:rFonts w:ascii="Cambria Math" w:h-ansi="Times New Roman"/><wx:font wx:val="Cambria Math"/><w:sz w:val="12"/><w:sz-cs w:val="12"/><w:lang w:val="EN-US"/></w:rPr><m:t> </m:t></m:r></m:oMath></m:oMathPara></w:p><w:sectPr wsp:rsidR="00000000"><w:pgSz w:w="12240" w:h="15840"/><w:pgMar w:top="1134" w:right="850" w:bottom="1134" w:left="1701" w:header="720" w:footer="720" w:gutter="0"/><w:cols w:space="720"/></w:sectPr></w:body></w:wordDocument>">  ;
;
Аллюмосиликаты:  O (глина) à каолин
O (глина) à каолин
Глина: 1)набухаемость; 2) Пластичность; 3) Связующая способность. Промышленные силикаты:
Стекло:  O*CaO*6
O*CaO*6  + 2
+ 2  Эмали и глазури: Э. – тонкие покрытия стеклянные силикатные на металле; Г. – на керамике; лучше эмали, не имеет пор. Эмаль держится лучше краски. Ситаллы – новые силикатные материалы мелкокристаллической структуры со стекловидной фазой 5%; они высокостойкие тверже углеродистой стали, легче алюминия, дешёвые.
Эмали и глазури: Э. – тонкие покрытия стеклянные силикатные на металле; Г. – на керамике; лучше эмали, не имеет пор. Эмаль держится лучше краски. Ситаллы – новые силикатные материалы мелкокристаллической структуры со стекловидной фазой 5%; они высокостойкие тверже углеродистой стали, легче алюминия, дешёвые.
23. Вода. Строение и св-ва в свободном состоянии. Лёд, жидкая вода. Адсорбция, абсорбция. Замерзание водных р-ов. Гидролиз, гидротация. Cв-ва: 1) при повыш. t происх. разлож. на эл.:  . 2) взаим. со всеми вещ-ми, химич. связь вода-вода, учавствующ. в строении крист. решеток различных минер. и вещ-в, входит в состав грунта. Кристаллогидраты –крист.,содержащие мол. воды .Гидрогели -мат-лы способные поглощ. и удерж. до 2л воды на 10г гидрогеля. Адсорбционная вода- образ. за счет притяж. молек. воды к активных центрам пов-ти минералов. Капиллярная вода- вид подз. вод,удержив. в порах горн. пород силами поверх-го натяжения. Адсорбция- процесс измен. концентрац. у пов-ти раздела 2х фаз;-повыш-е концетр. одного вещ-ва у пов-ти раздела 2х фаз, из которых одна обычно явл-ся твердым телом. Абсорбция- явление поглощ-я сорбата всем объемом сорбента. Хеносорбция -поглощ. жид-тью или тв. телом вещ-в из опред. среды, сопровожд-ся образ хим. соединения. Хим св-ва:1) +Me -
. 2) взаим. со всеми вещ-ми, химич. связь вода-вода, учавствующ. в строении крист. решеток различных минер. и вещ-в, входит в состав грунта. Кристаллогидраты –крист.,содержащие мол. воды .Гидрогели -мат-лы способные поглощ. и удерж. до 2л воды на 10г гидрогеля. Адсорбционная вода- образ. за счет притяж. молек. воды к активных центрам пов-ти минералов. Капиллярная вода- вид подз. вод,удержив. в порах горн. пород силами поверх-го натяжения. Адсорбция- процесс измен. концентрац. у пов-ти раздела 2х фаз;-повыш-е концетр. одного вещ-ва у пов-ти раздела 2х фаз, из которых одна обычно явл-ся твердым телом. Абсорбция- явление поглощ-я сорбата всем объемом сорбента. Хеносорбция -поглощ. жид-тью или тв. телом вещ-в из опред. среды, сопровожд-ся образ хим. соединения. Хим св-ва:1) +Me -  ; не Ме-
; не Ме-  ,
,  . 2)
. 2)  3) +оксиды неметалл.
3) +оксиды неметалл.  4) +окс. мет.
4) +окс. мет.  . 5) гидраты(молек. воды сохр.)
. 5) гидраты(молек. воды сохр.) 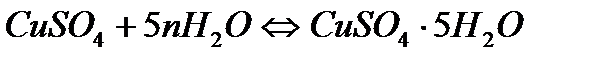 . 6) синтез раст-ми крахмала
. 6) синтез раст-ми крахмала  . Гидролиз- один из видов хим. реак-и, где при взаим-и вещ-в с водой происх. разлож. исх молек. с образ. новых соед-й. Гидратация- присоед. мол. воды к мол. или ионам. (движущ. сила электролит диссоциации)
. Гидролиз- один из видов хим. реак-и, где при взаим-и вещ-в с водой происх. разлож. исх молек. с образ. новых соед-й. Гидратация- присоед. мол. воды к мол. или ионам. (движущ. сила электролит диссоциации)
24.Вяжущие: 1) неорганические; 2) органические;
Неорг-е – материалы при смешивании с водой дают тесто, затвердевающее без действие извне. Хар-но: гидрофильность, способность образовывать тесто, затвердевать. Орг-е: битумы, смолы. Дают вяжущее тесто при нагревании или действии растворителей. Хар-но: гидрофобность, вяжущее тесто застывает после прекращения действия температуры. Неорганические используются для создания бетонов, бетоны образуются при: вяжущее, вода, заполнитель (песок, ПГС). Если нет заполнителя – то это просто раствор строительный. Вяжущие по условиям твердения и водостойкости: 1)воздушные (с водой твердеют на воздухе): известь или гипс. 2)Гидравлические – твердеют в воде и на воздухе прочность в воде повышается: партлан. Цемент, гидравл-я известь, алюминатный цемент. Св-ва: 1) Дисперсность; 2)Пластичность. 3) Способность к твердению. Повышение дисперсности: измельчение сырья, измельчение готовых вяжущих, ПАВ. Пластичность – способность восстанавливать форму после нагружения. Причина: мономолекулярные слои воды. Вода обладает св-ми льда. Вода – смазка. Повышение пластичности: увеличение объёма вяжущих; увеличение объёма воды; введение ПАВ (воздухововлекающие, гидрофилизующие, гидрофобизирующие). Служат интенсификаторами помола, улучшают порозостойкость, долговечность.
Твердение: единый механизм гидротационный. 1)схватывание; 2) твердение. Известь получают обжигом:  ;
;
 переклаз
переклаз
Получение вяжущего:1)помол; 2) Гашение;
Воздушная известь содержит. Твердение: карбонизация, перекристаллизация, образование гидросиликата кальция (Ca 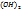 +2Si
+2Si  à
à  ); гидролиз, гидротация. Сырьевая смесь: известняк. 1450℃ Обжиг – задача как можно полнее связать известняк в высокоосновные силикаты. Состав клинкера: I. 3CaO* Si
); гидролиз, гидротация. Сырьевая смесь: известняк. 1450℃ Обжиг – задача как можно полнее связать известняк в высокоосновные силикаты. Состав клинкера: I. 3CaO* Si  . II. 2CaO* Si
. II. 2CaO* Si  . III. 3CaO*
. III. 3CaO* 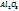 . IV. 4CaO*
. IV. 4CaO* 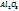 *
*  . I.Быстро твердеет, продукт прочный. II. Менее активен с водой, твердеет медленно, продукт твердеет во времени. III. Твердеет быстро, низкая прочность. IV. Твердеет медленно, прочность растёт. Вз-е с водой: I. Идут р-ии только гидролиза, потом гидротация: 3CaO* Si
. I.Быстро твердеет, продукт прочный. II. Менее активен с водой, твердеет медленно, продукт твердеет во времени. III. Твердеет быстро, низкая прочность. IV. Твердеет медленно, прочность растёт. Вз-е с водой: I. Идут р-ии только гидролиза, потом гидротация: 3CaO* Si  à2CaO* Si
à2CaO* Si  + Ca
+ Ca 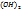 ; II. Только гидротация: 2CaO* Si
; II. Только гидротация: 2CaO* Si  à2CaO* Si
à2CaO* Si  ↓+ Ca
↓+ Ca 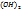 ; III. 3CaO*
; III. 3CaO*  à3CaO*
à3CaO*  ↓ à3CaO*
↓ à3CaO* 
 ↓; замедляет твердение цемента: 3CaO*
↓; замедляет твердение цемента: 3CaO*  +3 Сa
+3 Сa  +25(26)
+25(26)  à3CaO*
à3CaO* 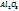 *3 Сa
*3 Сa  *31(32)
*31(32)  ↓ (сульфат.бацилла).IV.4CaO*
↓ (сульфат.бацилла).IV.4CaO* 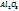 *
*  +(m+6)
+(m+6)  à3CaO*
à3CaO*  ↓+CaO*
↓+CaO*  +m
+m  ↓; Ускоряют процесс все вещества связывающие свободную известь. Ca
↓; Ускоряют процесс все вещества связывающие свободную известь. Ca  : +
: +  ; Замедляет – Мелясса – отходы сахарной промышленности. Коррозия Бетона. Начинается с цементного камня: Неоднородность: 1)наличии негидротированных зёрен цемента. 2)Наличие капиллярных ходов и форм; 3) Наличие свободной извести;
; Замедляет – Мелясса – отходы сахарной промышленности. Коррозия Бетона. Начинается с цементного камня: Неоднородность: 1)наличии негидротированных зёрен цемента. 2)Наличие капиллярных ходов и форм; 3) Наличие свободной извести;
Основные виды: 1)Вымывание свободной извести водой. 2) Образование в толще бетона рыхлых пористых соединений. 3)Образование сульфатной бациллы. Углекислотная коррозия: 1) CaC  + C
+ C  +
+  à
à 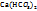 ; 2) Магнезиальная коррозия: Mg
; 2) Магнезиальная коррозия: Mg  + Ca
+ Ca  à Mg
à Mg  + Сa
+ Сa  ; 3)Сульфатная коррозия: 3CaO*
; 3)Сульфатная коррозия: 3CaO*  3 CaS
3 CaS  *31(32)
*31(32)  ; Надо добавить Si
; Надо добавить Si  (3я модификация): 3CaO*
(3я модификация): 3CaO*  CaS
CaS  *10
*10  ↓. Клинкер – идёт реакция и гидролиза и гидротации. Железобетон и его коррозия: 3Fe + C à
↓. Клинкер – идёт реакция и гидролиза и гидротации. Железобетон и его коррозия: 3Fe + C à 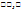 (цементит). Лучшая защита сухая свободная известь. Fe +
(цементит). Лучшая защита сухая свободная известь. Fe + 
 (ржавчина); Если прошла влага – самоуплотнение бетона (вымывание свободной извести).
(ржавчина); Если прошла влага – самоуплотнение бетона (вымывание свободной извести).
 Методы защиты: 1)Структурные изменения в бетоне (тромбование, виброуплотнение, торкретирование) Химическое уплотнение: а)Na2SiO3 + Ca(OH)2 à CaSiO3↓ + 2NaOH; CaCl2+Na2SiO3à CaSiO3+2NaCl; б)Флюатирование; в)Тетратизация – обработка винной к-той.г) Гидрофобизация – бетон.пов-ть должна отталкивать влагу. - обрабат. технич.мылами: С17Н35-СООNa; (С17Н35-COO)3Al; (С17Н35-COO)2Zn
Методы защиты: 1)Структурные изменения в бетоне (тромбование, виброуплотнение, торкретирование) Химическое уплотнение: а)Na2SiO3 + Ca(OH)2 à CaSiO3↓ + 2NaOH; CaCl2+Na2SiO3à CaSiO3+2NaCl; б)Флюатирование; в)Тетратизация – обработка винной к-той.г) Гидрофобизация – бетон.пов-ть должна отталкивать влагу. - обрабат. технич.мылами: С17Н35-СООNa; (С17Н35-COO)3Al; (С17Н35-COO)2Zn
- обрабат.метилсиликонами (СН3)4Si. Защита штукатурки: 1)обраб. Стеаратом Ca: (С17Н35СОО)2Са 2)хоз.мыло,из него 2х%й р-р на бензине(20%), парафине. 3)Pb3O4(отталк.воду) свинцовый сурик
 2018-01-21
2018-01-21 187
187






