Согласно правилу Вант-Гоффа, повышение температуры на каждые 10 градусов увеличивает скорость реакции в 2-4 раза.
 температурный коэффициент скорости реакции.
температурный коэффициент скорости реакции.

Пример.  и
и  тогда
тогда 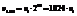
С ростом температуры происходит перераспределение энергии между молекулами так, что резко возрастает число активных молекул, облаающих некоторым избытком энергии (энергией активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.
С. Аррениус установил опытным путем зависимость: 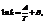 где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции.
где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции.
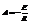 (энергия активации, постоянная – 8,31).
(энергия активации, постоянная – 8,31).
 2018-01-21
2018-01-21 384
384








