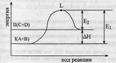
Рассмотрим график изменения энергии в процессе протекания экзотермической реакции.
Примечание автора. Обязательна графическая иллюстрация.

Уровень L отвечает наименьшему запасу энергии у молекул, которые необходим для их результативного столковения.
Разность L и I – энергия активации прямой реакции, L и II – обратной.
По пути из исходного состояния в конечное система должна пройти через некоторый энергетический барьер. И только активные молекулы могут его преодолеть.
Рассмотрим график изменения энергии в процессе протекания эндотермической реакции.
Примечание автора. Обязательна графическая иллюстрация.
Проведем небольшие преобразования:
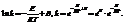
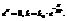
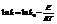 - эмпирическое уравнение Аррениуса.
- эмпирическое уравнение Аррениуса.
Энергия активации химической реакции. Аналитический и графический метод расчета.
С ростом температуры происходит перераспределение энергии между молекулами так, что резко возрастает число активных молекул, облаающих некоторым избытком энергии (энергией активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.
С. Аррениус установил опытным путем зависимость: 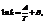 где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции.
где к – константа скорости, А и В – индивидуальные постоянные, характерные для данной реакции.
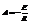 (энергия активации, постоянная – 8,31).
(энергия активации, постоянная – 8,31).
 2018-01-21
2018-01-21 1389
1389
