Свойства тел при их механическом и тепловом взаимодействия друг с другом достаточно хорошо могут быть описаны на основе молекулярно - кинетической теории. Согласно этой теории все тела состоят из мельчайших частиц – атомов, молекул или ионов, которые находятся в непрерывном хаотическом движении, называемом тепловым, и взаимодействуют между собой. Движение этих частиц подчиняется законам механики. Состояние системы таких частиц определяется совокупностью значений ее термодинамических параметров (или параметров состояния), т.е. физических величин, характеризующих макроскопические свойства системы. Обычно в качестве параметров состояния выбирают температуру, давление, удельный объем. Внутренней энергией такой системы называется энергия, зависящая только от состояния термодинамической системы. Внутренняя энергия системы состоит из кинетической энергии молекул, составляющих систему, потенциальной энергии их взаимодействия друг с другом, внутримолекулярной энергии (т.е. энергии взаимодействия атомов или ионов в молекулах, энергии электронных оболочек атомов и ионов, внутриядерной энергии) и энергии электромагнитного излучения в системе.
Система может обладать также и внешней энергией, которая представляет собой сумму кинетической энергия движения системы как целого (кинетической энергии центра масс системы) и потенциальной энергии системы в поле внешних сил. Внутренняя и внешняя энергия составляют полную энергию системы.
Однако строгий подсчет внутренней энергии тела затруднен. Внутренняя энергия может быть определена только с точностью до постоянного слагаемого, которое нельзя найти методами термодинамики. Но в большинстве случаев приходится иметь дело только с изменениями внутренней энергии D U, а не с ее абсолютным значением U, поэтому отсчет внутренней энергии можно вести от внутримолекулярной энергии, которую в большинстве случаев можно считать постоянным слагаемым. Чаще всего за нуль внутренней энергии (U =0) принимают энергию, которой обладает система при абсолютном нуле (т.е. T =0 K).
Внутреннюю энергию тела можно изменить путем теплообмена или механическим воздействием, т.е. производя над телом работу. Теплообмен и механическое воздействие в ряде случаев могут приводить к одинаковым изменениям внутренней энергии тела. Это дает возможность сравнивать теплоту и работу и измерять их в одинаковых единицах. Теплота представляет собой энергию, которая передается от одного тела к другому при их контакте или путем излучения нагретого тела, т.е. по существу мы имеем дело с работой, которую совершают уже не макроскопические тела, а хаотически движущиеся микрочастицы. Таким образом, термодинамическая система может получать или отдавать некоторое количество теплоты dQ, может производить работу или над ней может быть произведена работа. Совершение системой или над системой работы является перемещение взаимодействующих с ней внешних тел. В случае квазистатического, равновесного процесса элементарная работа dA, совершенная для изменения объема тела на величину dV, равна
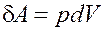 , где p - давление.
, где p - давление.
Данная работа dA называется работой расширения и представляет собой работу, которую система производит против внешних сил.
Полная работа при переходе системы из состояния с объемом V1 в состояние с объемом V2 будет равна
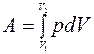 .
.
Из геометрического смысла определенного интеграла следует, что работа А, совершаемая системой при переходе из первого состояния во второе, будет равна площади под кривой, описывающей данный процесс в координатах p, V (т.е. заштрихованной площади криволинейной трапеции, см. рис.1). Следовательно, работа зависит не только от начального и конечного состояния системы, но и от того каким образом был осуществлен переход из одного состояния в другое.
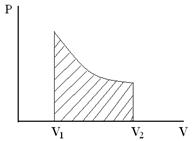
Рис.1.
Работа, как и теплота, зависит от того, каким образом осуществляется процесс. Работа и теплота наряду с внутренней энергией также являются формами энергии. Закон сохранения энергии в термодинамике называют первым началом (или первым законом) термодинамики.
Для практического использования первого начала термодинамики надо условиться о выборе знака для теплоты и работы. Теплоту будем считать положительной, когда она сообщается системе, а работу положительной, когда система совершает ее против действия внешних сил.
Первое начало термодинамики формулируется следующим образом: количество сообщенного системе тепла dQ расходуется на изменение внутренней энергии системы dU и совершение работы dA этой системой над внешними телами.
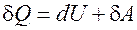 (4)
(4)
Внутренняя энергия является полным дифференциалом. Она не зависит от вида процесса, а определяется только начальным и конечным состоянием системы. При циклическом процессе изменение внутренней энергии равно нулю, т.е. Q = A.
30. Температура. Температурные шкалы. Теплоемкость и внутренняя энергия идеального газа. Теплоемкости Ср и Сv
Температура — одно из основных понятий, играющих важнейшую роль в физике в целом.
Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы и определяющая направление теплообмена между телами.
Понятие температуры в термодинамике введено исходя из следующих положений:
1. Если тела А и В находятся в тепловом контакте, и теплота переходит от тела А к телу В, то температура тела А выше.
2. Если теплота не переходит от тела А к телу В и наоборот, тела А и В обладают одинаковой температурой.
3. Если температура тела А равна температуре тела С и температура тела В равна температуре тела С, то тела А и В также обладают равной температурой.
В молекулярно-кинетической теории газов показано, что температура является мерой средней кинетической энергии поступательного движения молекул.
Температура измеряется с помощью термометрических тел (какой либо параметр которых зависит от температуры).
В настоящее время используют две температурные шкалы.
- Международная практическая шкала (шкала Цельсия), градуированная в градусах Цельсия (°С) по двум реперным точкам — температурам замерзания и кипения воды при давлении 1,013·105 Па, которые принимаются соответственно 0°С и 100°С.
- Термодинамическая температурная шкала (шкала Кельвина), градуированная в градусах Кельвина (К), определяется по одной реперной точке — тройной точке воды — температуре, при которой лед, вода и насыщенный пар при давлении 609 Па находятся в термодинамическом равновесии. Температура этой точки по данной шкале равна 273,16 К. Температура T= 0 K называется нулем Кельвина.
Термодинамическая температура (T) и температура (t) по шкале Цельсия связаны соотношением Т =273,15+ t
Различные тела можно нагреть до одной и той же температуры путем подведения различного количества теплоты. Это означает, что различные вещества обладают разной восприимчивостью к нагреванию.
Эту восприимчивость характеризует величина, называемая теплоемкостью.
 2014-02-02
2014-02-02 11313
11313
