Рассмотрим гальванический элемент Даниэля- Якоби.
Элемент Даниэля–Якоби
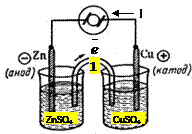
1 – сифоновая трубка, как правило заполненная KCl
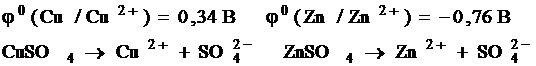 Потенциал, определяющий равновесие:
Потенциал, определяющий равновесие:
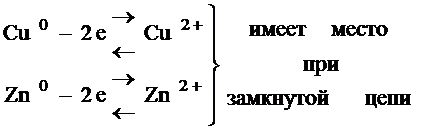
При замыкании цепи цинковая пластина начинает терять электроны. Тогда появляется возможность для переходов катиона цинка из пластины в электроны. Электрод, который имеет меньший потенциал (Zn) в гальваническом элементе является анодом, при замыкании цепи потенциал, измеряющий равновесие перемещается в сторону окисления металла. Анодный процесс:
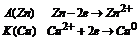
Цинковая пластина растворяется (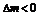 ) медная пластина наращивается. Работает, пока цинковая пластина не растворится
) медная пластина наращивается. Работает, пока цинковая пластина не растворится 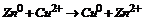 .
.
Гальванический элемент (химический источник тока) – устройство, в котором химическая энергия окислительно-восстановительных реакций преобразуется в электрическую энергию.
В гальваническом элементе процессы окисления и восстановления пространственно разделены. За счет чего становится возможным движение зарядов электронов во внешней цепи, а ионов во внутренней цепи.
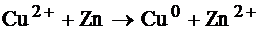
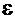 -электролитическая сила гальванического элемента
-электролитическая сила гальванического элемента
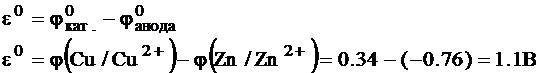
Электронная схема гальванического элемента начинается для электрона с меньшего потенциала, то есть с анода.
 Zn0/Zn2+//Cu2+/Cu0
Zn0/Zn2+//Cu2+/Cu0
Возрастает 
Химические источники тока – это устройства, используемые в быту и технике для получения электрической энергии за счет химических реакций. Их достоинство иметь источник энергии, не имея доступа к центральному источнику электрической энергии.
1. Марганцево-цинковые элементы (сухие элементы) бывают стаканчиковые, пуговичные, галетные (кубические).
Действие элемента основано на реакции:
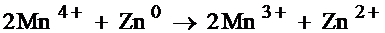
Работа марганцево-цинкового элемента протекает следующим образом:
Цинковый стаканчик – анод – растворяется:
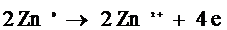
электролит – паста из NH4Cl – взаимодействует с ионами Zn2+:
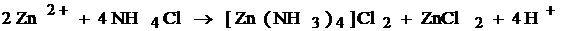 Электроны от цинка по внешней цепи идут к катоду, изготовленному из пакета MnO2, и сюда же приходят ионы H+ по внутренней цепи:
Электроны от цинка по внешней цепи идут к катоду, изготовленному из пакета MnO2, и сюда же приходят ионы H+ по внутренней цепи:
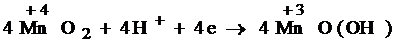
Водород не выделяется, так как MnO2 очень хороший деполяризатор.
Стаканчиковый
1.
 Цинковый стаканчик
Цинковый стаканчик
2. Угольный стержень
3. Материал пропитанный пастой из MnO2
4. Электролит NH4Cl
При разомкнутой цепи на электродах равновесие следующее
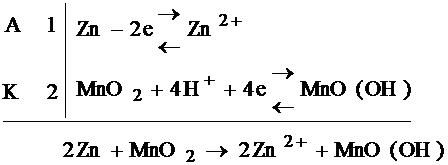
Катионы цинка связываются электролитом
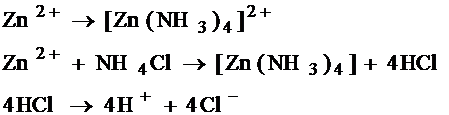
Галетный. Отличие: отсутствует угольный электрод, что позволяет монтировать батареи значительно компактнее.
1-биполярный проводящий слой;
2-цинковый электрод;
3-хлорвиниловый корпус;
4-паста-электролит;
5-бумажная прокладка;
6-положительный электрод (MnO2);
Пуговичный. Отличие: самый компактный и упрощённый вид батареи.
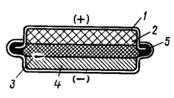
1-оболочка из металла;
2-положительный электрод (MnO2);
3-сепаратор с щелочным электролитом;
4-цинковый электрод;
5-изолятор
Аккумуляторы.
Аккумуляторы – это системы позволяющие накапливать заряды, поддерживать разность потенциалов и восстанавливать возможность дальнейшей работы в качестве источников тока за счет обратимости электродных процессов при использовании внешних источников энергии.
Свинцово-кислотный аккумулятор. Основы и сущность процессов протекающих на электродах при его работе, применение.
Свинцово-кислотный аккумулятор основан на окислительно-восстановительной реакции 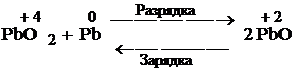
Свинцово-кислотный аккумулятор состоит из решётчатых свинцовых пластин, поры в решётках заполнены. В одной – губчатый свинец (Pb), в другой решётке паста из оксида свинца (PbO2). Пластины погружены в электролит H3SO4 (ρ=1,23г/см3,ω(H3SO4)=35,4%)
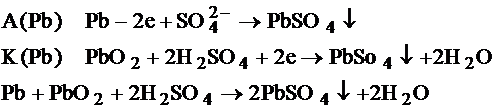
Путем присоединения к внешнему источнику постоянного тока, то можно осуществить обратный процесс.
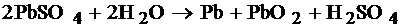
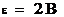
Электрохимическая связь.
Pb/PbSO4//H2SO4//PbSO4/PbO2
Преимущество свинцового аккумулятора – большая электрическая ёмкость, устойчивость в работе, большое количество циклов (разрядка-зарядка).
Недостатки – агрессивность электролита, токсичность свинца, высокая масса, большие габариты.
Применение: наиболее широко применяется в технике. Он служит источником тока для стартёров двигателей внутреннего сгорания, для аварийного освещения и других целей.
27) Марганцево-цинковый элемент — это первичный химический источник тока, в котором катодом является двуокись марганца MnO2 (пиролюзит) в смеси с графитом (около 9,5 %), анодом – металлически цинк Zn, электролитом - желеобразный раствор Хлористого Аммония с добавкой различных загустителей для увеличения вязкости.
При работе элемента цинк окисляется:
2Zn-4e- = 2Zn2+.
Часть образующихся ионов цинка связывается молекулами аммиака в комплексный ион:
Zn2++4NH3 = [Zn(NH3)4]2+.
Молекулы аммиака образуются в растворе вследствие гидролиза иона аммония:
4NH4++4H2O = 4HN3+4H3O+.
Электроны, получающиеся при окислении цинка, по внешней цепи переходят к диоксиду марганца, который при этом восстанавливается:
4MnO2+4H3O++4e- = 4MnO(OH)+4H2O.
Если сложить все 4 уравнения, то получится ОВР, идущая в элементе:
2Zn+4MnO2+4NH4+ = =Zn2++[Zn(NH3)4]2++4MnO(OH).
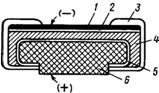
Устройство марганцово-цинкового сухого элемента:
(1) — металлической колпачок,
(2) — графитовый стержень,
(3) — цинковый корпус,
(4) — влажная паста из хлорида аммония, диоксида марганца, и графитовой крошки,
(5) — металлический контакт.
28) Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: аккумуляторные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде.
Энергия возникает в результате взаимодействия оксида свинца и серной кислоты до сульфата (классическая версия). Проведенные исследования в СССР показали, что внутри свинцового аккумулятора протекает как минимум ~60 реакций, порядка 20 из которых протекают без участия кислоты электролита(нехимические)[1]
Во время разряда происходит восстановление диоксида свинца на катоде[2][1] и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева-направо — разряд, справа-налево — заряд):
29)
Сущность электролиза
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу — анод, после чего погружают их в электролизер с раствором или расплавом электролита.
Электроды, как правило, бывают металлические, но применяются и неметаллические, например графитовые (проводящие ток).
На поверхности электрода, подключенного к отрицательному полюсу источника постоянного тока (катоде), ионы, молекулы или атомы присоединяют электроны, т. е. протекает реакция электрохимического восстановления. На положительном электроде (аноде) происходит отдача электронов, т. е. реакция окисления. Таким образом, сущность электролиза состоит в том, что на катоде происходит процесс восстановления, а на аноде — процесс окисления.
В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т. п., — так называемые вторичные процессы.
Металлические аноды могут быть: а) нерастворимыми или инертными (Pt, Au, Ir, графит или уголь и др.), при электролизе они служат лишь передатчиками электронов; б) растворимыми (активными); при электролизе они окисляются.
30) Процессы поляризации, определяемые, в общем случае, как разность потенциалов поляризации 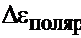 , представляют собой результат изменения электродного потенциала катода и анода под действием проходящего тока:
, представляют собой результат изменения электродного потенциала катода и анода под действием проходящего тока:

На процессы поляризации электродов влияет не только величина тока, но и поверхность электрода, т. е. плотность тока j:
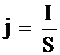 , где S – поверхность электрода (см2, дм2), j – плотность тока (А/см2, А/дм2).
, где S – поверхность электрода (см2, дм2), j – плотность тока (А/см2, А/дм2).
Природа процессов, изменяющих электродные потенциалы различна, и поляризационные процессы можно разделить на несколько типов:
1) Концентрационная поляризация возникает за счёт концентрации ионов в поверхностном слое электрода.
2) Газовая поляризация возникает, главным образом, на катоде гальванического элемента или электролизёра за счёт разрядки ионов водорода.
3) Химическая поляризация изменяет поверхность электрода за счёт реакций со средой или электролита при прохождении электрического тока.
31) Самопроизвольно протекающий процесс разрушения металлов в результате взаимодействия с окружающей средой, происходящий с выделением энергии и рассеиванием вещества (рост энтропии), называется коррозией. Коррозионные процессы протекают самопроизвольно и необратимо в соответствии со вторым началом термодинамики.
Химческая сторона коррозии – это всегда окисление металла, которое сопровождается переходом его 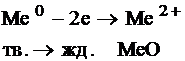
Физическая сторона этого процесса связана:
1. диффузия компонентов среды поверхности металла;
2. возникновение электродных потенциалов;
3. если есть превращение одних веществ металла в другие (окислы, соли). Происходит изменение физических свойств в зависимости от условия протекания, а следовательно, среды эксплуатации конструкции различают:
- газовую (высокотемпературную);
- атмосферную;
- почвенную;
- в водной среде;
- коррозию в жидких не электролитах (бензине, маслах);
- в электролитах, при кислотных дождях.
В зависимости от условий коррозии имеет различный механизм, газовая в сокотемпературная и коррозия в не электролитах протекает как химическая коррозия, то есть имеет место непосредственного взаимодействия металла с кислородом или другими окислителями.
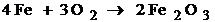
32)
Можно выделить несколько направлений борьбы с коррозией:
I группа: структурирование материала на стадии получения сплавов. Первое направление обусловлено учетом условий коррозии при конструировании технических устройств. Если в техническом устройстве в качестве конструкционных материалов одновременно используются медь и железо, цинк и железо и т. д., то, очевидно, такое техническое устройство будет быстро коррозировать.
II группа: нанесение покрытий. Нанесению покрытий должно предшествовать подготовка поверхности материала, а при нанесении необходимо соблюдать технологические режимы это обеспечивает сохранение однородности материала. Второе направление борьбы с коррозией — это тщательная покраска технического устройства. Например, автомобилисты покрывают днище, крылья и двери автомобиля специальной мастикой, которая препятствует проникновению к поверхности металла воздуха и влаги.
III группа: электрохимические методы защиты. Третье направление защиты от коррозии — так называемая протекторная защита металла. Для защиты металла специально создаются условия для электрохимической коррозии. Но делают это так, чтобы нужный металл не разрушался, а коррозировал специально закрепленный другой металл. Например, если к стальной поверхности прикрепить цинковые пластинки, то коррозировать будет цинк. Стальная поверхность, таким образом, будет защищена. У нас в стране был опыт использования протекторной защиты автомобилей. Для этого государственные регистрационные номера изготовляли из цинка. Предполагалось, что в процессе эксплуатации разрушаться будут номера, а автомобиль — нет. Но эксплуатация таких «защищенных» автомобилей в условиях крупных городов, в которых зимой дороги посыпаются солью, приводит к настолько быстрой коррозии, что протекторная защита не спасает. Кроме того, через несколько лет цинковые номера настолько сильно разрушились, что возникла проблема их замены.
IV группа: активирование или пассивирование поверхности материала. Четвертое направление защиты от коррозии — это покрытие одного металла другим, более устойчивым к коррозии. Так, иногда части технических устройств покрывают никелем или хромом. Они выглядят очень привлекательно и устойчивы к коррозии.
 2018-01-21
2018-01-21 898
898







